순수한 원소 코발트. (Alchemist-HP)
코발트는 주기율표 및 요소 심볼 Co의 원자 번호 27입니다.이 단단한 청색 회색 전이 금속은 합금에 사용되며 유리에 파란색을 부여합니다. 다음은 특성, 용도 및 건강 영향을 포함한 코발트 사실입니다.
코발트 사실

코발트
발견 :Cobalt 화합물은 청동기 시대 이후 유리에 푸른 색을 부여하기 위해 사용되었습니다. 스웨덴 화학자 인 조그 브란트 (Georg Brandt)는 1735 년경 에이 요소를 발견했다.
이름 :요소 이름 cobalt 독일어 kobold 에서 비롯됩니다 ,“고블린”을 의미합니다. 광부는 제련 중에 방출 된 독성 증기와 코발트 광석이 니켈 또는 구리의 제련 과정을 엉망으로 만드는 방식을 언급하면서 코발트 광석 Kobold라고 불렀습니다. 코발트 광석에는 일반적으로 광부와 제련소를 독살 한 비소 산화물이 포함되어 있습니다.
속성 :코발트는 철이나 니켈과 유사한 단단하고 부서지기 쉬운 전환 금속입니다. 가장 흔한 산화 상태는 +2 또는 +3입니다. 요소는 자성이며, 철의 3 분의 2는 철분의 3 분의 2의 자기 투과성입니다. 금속은 두 개의 할당수를 형성합니다. 400 ° C 미만, 베타 형태가 우세합니다. 알파 형태는 400 ° C 이상의 온도에서 더 흔합니다. 코발트의 융점은 1495 ° C이고 끓는점은 2870 ° C입니다. 그것의 비중은 20 ° C에서 8.9입니다.

코발트 유리는 색상에 사용되며 광에 민감한 액체를 보호합니다. (Jurii)
사용 :고대 이집트, 폼페이, 탕 왕조 및 명이 왕조에 사용되는 유리와 유약의 파란색은 코발트 화합물을 사용하는 것입니다. 오늘날 코발트 블루는 유리와 페인트에 인기있는 색소로 남아 있습니다.
코발트는 경도와 부식 저항을 추가하기 위해 합금에 추가됩니다. 또한 자석을 만드는 데 사용됩니다. 동위 원소 코발트 -60은 트레이서, 감마 소스 및 방사선 치료제로 사용됩니다. 또한 음식을 멸균하는 데 사용됩니다.
동위 원소 :유일한 안정적인 동위 원소는 코발트 -59입니다. CO-50에서 CO-75까지 26 개의 알려진 동위 원소가 있습니다. Cobalt-60은 연구, 상업 및 의료 목적을위한 중요한 방사성 동위 원소입니다. 반감기는 5.27 년입니다. 코발트는 또한 코발트 폭탄으로 알려진 "더러운"폭탄을 만드는 데에도 사용됩니다.
생물학적 역할 :코발트는 인간, 동물 및 식물 영양에 필수적인 미량 요소입니다. 비타민 B-12 분자의 일부입니다. 그러나 철과 마찬가지로 코발트에 대한 과잉 노출은 잠재적으로 치명적인 의학적 상태를 유발할 수 있습니다. 니켈 및 크롬과 마찬가지로 코발트는 피부 접촉시 접촉 피부염을 유발합니다. 흡입하면 호흡기 고통을 유발합니다. 담배 연기의 자연스러운 구성 요소입니다. 1966 년 맥주 폼을 안정화시키는 데 사용 된 코발트 화합물은“맥주 마시는 사람의 심근 병증”으로 알려진 상태를 일으켰습니다. ld 50 코발트 소금의 경우 150 mg/kg ~ 500 kg/mg입니다.
출처 :코발트는 R- 프로세스를 통해 초신성으로 형성됩니다. 요소는 많은 화합물로 존재하지만 순수한 (고유) 형태는 아닙니다. 코발트의 공급원에는 미네랄 스몰 타이트, 에리스 라이트 및 코발티이트가 포함됩니다. 코발트는 니켈, 구리,은, 철 및 납 광석으로 발생합니다. 이 요소는 또한 많은 운석에서도 발견됩니다.
코발트 원자 데이터
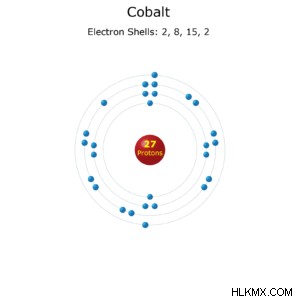
코발트 원자 전자 구성.
다음은 IUPAC에서 인정하는 코발트의주기적인 테이블 날짜입니다.
- 요소 기호 :Co
- 원자 번호 :27
- 표준 원자 무게 :58.933194 (3)
- 외관 :코발트는 빛나고 단단한 청색 회색 금속입니다.
- 그룹 :그룹 9 (전이 금속)
- 기간 :기간 4
- 블록 :D- 블록 요소
- 전자 구성 :[ar] 3d 4s
- STP의 단계 :단단한
- 용융점 :1768 K (1495 ° C, 2723 ° F)
- 끓는점 :3200 K (2927 ° C, 5301 ° F)
- 밀도 :8.90 g/cm
- 산화 상태 :-3, -1, +1, +2 , +3 , +4, +5
- 전기 음성 :1.88 (Pauling Scale)
- 이온화 에너지 :1st :760.4 kj/mol; 2nd :1648 kj/mol; 3 번째 :3232 kj/mol
- 원자 반경 :125 PM (경험적 데이터)
- 결정 구조 :육각형 가까운 포장 (HCP)
- 발견 :Georg Brandt (1735)
참조
- Greenwood, Norman N.; Earnshaw, Alan (1997). 요소의 화학 (제 2 판). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Meija, J.; et al. (2016). "2013 년 요소의 원자량 (IUPAC 기술 보고서). 순수하고 응용 화학 . 88 (3) :265–91. doi :10.1515/Pac-2015-0305
- 주, Mary Elvira (1932). “요소의 발견. III. 약 18 세기 금속”. 화학 교육 저널 . 9 :22. doi :10.1021/ed009p22