
히드로 플루오르 산 또는 HF는 매우 강력하고 부식성 산입니다. 그러나 그것은 강산이 아닌 약산으로 분류됩니다. 이것은 HF가 강산으로 분류되지 않은 유일한 히드로 할산산으로 만듭니다 (예 :HCL, HBR, HI).
.왜 Hydrofluoric acid가 약산 인 이유
Hydrofluoric acid가 약산 인 단순한 이유는 물에서 이온에 완전히 분리되지 않기 때문입니다 (강산의 정의). 처음에 HF는 실제로 를 수행합니다 거의 완전히 분리 :
hf + h 2 o 3 h 3 o+ f
그러나 산이 분리 된 후에는 그 자체와 물과의 다른 반응에 참여합니다. 히드로 플루오르 산의 거동은 물의 농도에 크게 의존합니다. 히드로 늄 양이온 및 불소 음이온은 서로 밀접하게 끌어와 H 3 를 형성합니다. O · F.이 종의 화학적 결합은 산도를 제한하기에 충분히 강하므로 히드로 플루오르 산은 희석 용액에서 매우 약한 산입니다.
농축 된 HF 용액은 강산과 매우 흡사합니다. 이는 화학적 결합이 염기와 컨쥬 게이트 산 사이에 형성되는 동종 해소에 기인합니다.
3 hf
수소와 불소 사이의 수소 결합은 FHF 비 플루오 라이드 이온을 안정화시킨다. 수소 결합은 또한 HF가 다른 수소 할로이드보다 높은 비등점을 갖도록합니다.
은 HF Polar?
입니다두 가지 요소가 산 강도로 작용합니다 :원자 크기와 H-A 결합의 극성 (여기서 A는 산입니다). 불소는 고도로 전기 음성이므로 HF의 결합은 극성 공유 결합입니다. 극성이 더 많을수록 산에서 양성자 또는 수소를 제거하는 것이 더 쉬워집니다. 따라서, 염산 (HCL)은 수소산 (HBR)보다 더 강한 산입니다. 극성에만 근거하여 HF가 HCl보다 강해질 것으로 예상 할 수 있습니다. 그러나 HF는 해리 후 반응에 참여하여 약한 산으로 만듭니다!
약하지만 위험한
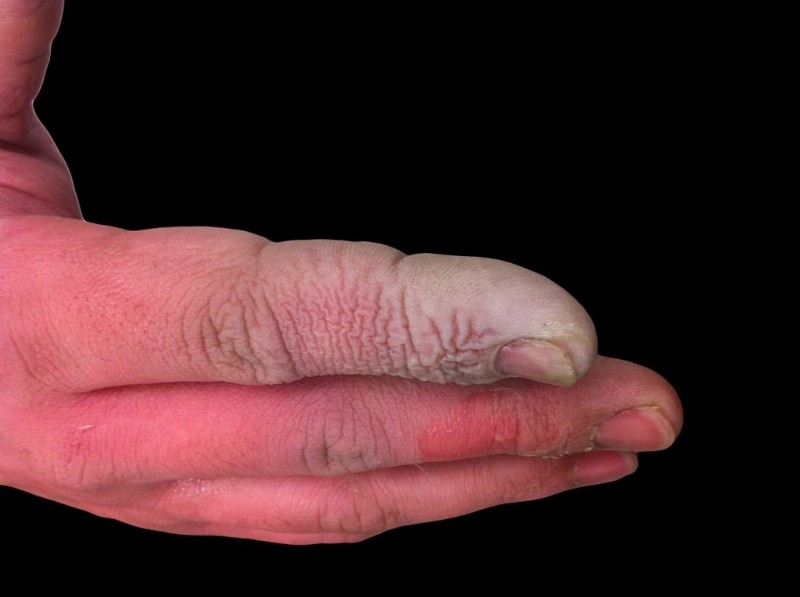
HF는 약산이지만 부식성이 높습니다. 희석액에서도 유리를 공격하므로 플라스틱 용기에 저장해야합니다. 몇 가지 이유로 함께 일하는 것이 위험합니다. 첫째, HF는 신경 기능을 방해하므로 다른 산과 마찬가지로 노출이 즉시 고통스럽지 않습니다. 둘째, 조직을 통해 흡수되므로 피부 나 점막에 화학적 화상을 입는 것 이상을 수행합니다. 궁극적으로, 산은 조직으로 더 깊이 작동하여 폐에 뼈 손상과 유체 축적을 유발합니다. 히드로 플루오르 산 화상은 심각하지는 않지만 즉각적인주의가 필요합니다.
참조
- Favre, Henri A.; Powell, Warren H., eds. (2014). 유기 화학의 명칭 :IUPAC 권장 사항 및 선호 이름 2013 . 케임브리지 :왕립 화학 학회. ISBN 9781849733069.
- Giguère, Paul A.; Turrell, Sylvia (1980). “하이드로 플루오르 산의 특성. 양성자-전달 복합체 H 3 의 분광 연구 의". j. 오전. 화학 Soc . 102 (17) :5473. doi :10.1021/ja00537a008
- prkić, ante; Giljanović, Josipa; 브랄 리치, 마리하; Boban, Katarina (2012). "이온 선택 플루오 라이드 전극을 사용하여 불소 종의 직접 전위차 측정". int. J. 전기 화학. Sci . 7 :1170–1179.







