유사성 :
* 비금속 : 황은 산소, 질소 및 염소와 같은 비금속입니다. 이것은 전기를 잘 전달하지 않고 일반적으로 부서지기 쉬우 며 화학 반응에서 전자를 얻는 경향이 있음을 의미합니다.
* 은 화합물을 형성합니다 : 대부분의 다른 요소와 마찬가지로 황은 다른 원소와 결합하여 화합물을 형성 할 수 있습니다. 특히 산소 (황 산화물) 및 금속 (황화물)이있는 화합물로 유명합니다.
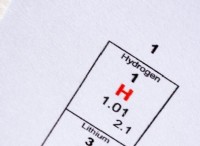
* 주기성 테이블 위치 : 황은 산소, 셀레늄, 텔루 리움 및 폴로늄과 함께 주기성 테이블의 그룹 16 (chalcogens라고도 함)에 있습니다. 동일한 그룹 내의 요소는 동일한 수의 원자가 전자 (가장 바깥 쪽 쉘에 전자)를 가지기 때문에 유사한 화학적 특성을 공유합니다.
차이점 :
* 반응성 : 황은 반응성이지만 산소 나 염소만큼 반응하지 않습니다. 일반적으로 반응을 겪으려면 더 높은 온도 또는 특수 조건이 필요합니다.
* 동반자 : 황은 각각 다른 특성을 갖는 여러 다른 동종 (구조가 다른 형태)을 가지고 있습니다. 가장 흔한 것은 노란색, 결정질 황이지만 고무 같은 황과 바이올렛 황과 같은 형태가 있습니다. 다른 비 메탈에서는 덜 일반적입니다.
* 사용 : 황은 다른 요소가 공유하지 않는 특정 용도를 가지고 있습니다. 황산 (주요 산업 화학 물질), 고무 가황 및 비료의 생산에 사용됩니다.
전반적으로 :
유황은 고유 한 특성을 가진 매혹적인 요소로 다른 요소와 유사하고 다릅니다. 그룹의 다른 비 메탈과의 유사성 및 화합물을 형성하는 능력은 중요한 특성이지만, 반응성, 동반 및 특정 용도로 인해 고유 한 응용 세트가있는 고유 한 요소가됩니다.