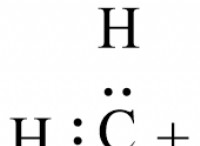* 베릴륨의 작은 크기와 높은 전하 밀도 : 베릴륨은 그룹 2에서 가장 작은 요소이며, 전하 밀도가 매우 높습니다 (전하/부피 비율). 이것은 물 분자에 대한 전자 쌍과 고독한 전자 쌍 사이의 매우 강한 인력으로 이어진다. 이 강력한 상호 작용은 Becl₂의 격자 에너지를 극복하고 용해시킬 수 있습니다.
* 다른 그룹 2 요소의 더 큰 이온 크기 및 낮은 전하 밀도 : 그룹 2를 내려 가면 이온 반경이 증가하고 전하 밀도가 감소합니다. 이것은 금속 양이온과 물 분자 사이의 상호 작용을 약화시킵니다. 염화물의 격자 에너지가 지배적이되어 덜 용해됩니다.
여기에 고장이 있습니다 :
* becl bec : 작은 크기 및 높은 전하 밀도로 인한 Be² be 이온의 강한 수화는 격자 에너지를 극복하여 용해도를 초래합니다.
* mgcl> : mg² ⁺의 크기가 크기 때문에 적당한 용해도. 수화는 여전히 발생하지만 Be²⁺보다 덜 강합니다.
* cacl>, srcl₂, bacl₂ : 이들은 일반적으로 가용성으로 간주되지만 그룹을 내려 가면 용해도가 감소합니다. Ca² ca, Sr²⁺ 및 Ba²⁺의 수화는 약하지만, 많은 경우 격자 에너지를 극복하기에 충분히 중요합니다.
요약 : 물에서 그룹 2 클로라이드의 용해도는 수화 엔탈피 (이온이 물 분자로 둘러싸 일 때 방출되는 에너지)와 격자 엔탈피 (고체 결정 격자를 분리하는 데 필요한 에너지) 사이의 균형입니다. 베릴륨의 작은 크기와 높은 전하 밀도는 수화를 선호하는 반면, 다른 그룹 2 요소의 더 큰 크기 및 하위 충전 밀도는 격자 에너지를 선호합니다.