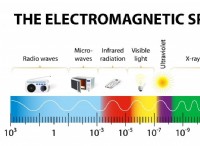
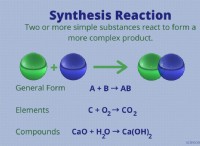
1. 기본 사항을 이해하십시오
* 산화 수 : 모든 결합이 100% 이온 인 경우 원자가 가질 수있는 전하를 나타냅니다. 화학 반응에서 전자 이동을 추적하는 부기 도구입니다.
* 이온 : 전자를 얻거나 잃어버린 원자 또는 원자 그룹은 순 양성 또는 음전하를 초래합니다.
2. 주요 규칙
* 규칙 1 :자유 요소의 산화 번호는 항상 0입니다. (예 :NA, O2, CL2)
* 규칙 2 :모나토미 이온의 산화 수는 그 전하와 같습니다. (예 :Na + =+1, Cl- =-1, O2- =-2)
* 규칙 3 :중성 화합물에서 산화 수의 합은 항상 0입니다.
* 규칙 4 :다 원자 이온에서 산화 수의 합은 이온의 전하와 같습니다.
* 규칙 5 :산소는 일반적으로 과산화물 (-1)을 제외하고는 산화 수가 -2이고 불소에 결합 된 경우 (위치)
* 규칙 6 :수소는 일반적으로 금속에 결합 될 때 (-1)를 제외하고는 +1의 산화 수를 갖습니다.
* 규칙 7 :그룹 1 요소 (알칼리 금속)는 항상 +1의 산화 번호가 있습니다.
* 규칙 8 :그룹 2 요소 (알칼리성 지구 금속)는 항상 산화 수가 +2입니다.
* 규칙 9 :할로겐 (그룹 17)은 일반적으로 산소 또는 다른 할로겐에 결합 된 경우를 제외하고는 일반적으로 -1의 산화 수를 갖는다.
3. 규칙 적용
예 1 :설페이트 이온에서 황의 산화 수를 결정합니다 (SO4^2-)
1. 산소 산화 수 : -2 (규칙 5)
2. 산소로부터의 총 산화 수 : 4 원자 x -2 =-8
3. 산화 수의 합계는 이온의 전하와 동일해야합니다. -8 + x =-2
4. X (황의 산화 수) : x =+6
예 2 :과망간산염 이온에서 망간의 산화 수를 결정합니다 (MNO4-)
1. 산소 산화 수 : -2 (규칙 5)
2. 산소로부터의 총 산화 수 : 4 원자 x -2 =-8
3. 산화 수의 합계는 이온의 전하와 동일해야합니다. -8 + x =-1
4. X (망간의 산화 수) : x =+7
키 포인트
* 규칙을 논리적 순서로 사용하여 알려지지 않은 요소의 산화 번호를 결정하십시오.
* 때때로 시행 착오를 사용해야 할 수도 있습니다.
* 자신감을 얻기 위해 다양한 사례로 연습하십시오.