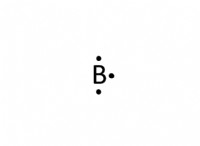* 탄소 (C) : 4 개의 원자가 전자 (가장 바깥 쪽 쉘에 전자)가 있습니다.
* 산소 (O) : 6 개의 원자가 전자가 있습니다.
1. 총 원자가 전자 :
* 탄소 :4 개의 전자
* 산소 (3 개의 원자) :6 개의 전자/원자 * 3 원자 =18 전자
* 총 :4 + 18 =22 원자가 전자
2. 이상적인 낙지 :
* 원자는 8 개의 원자가 전자의 안정적인 구성을 달성하기 위해 전자를 얻거나 잃는 경향이 있습니다 (Octet Rule).
3. co⁻²₃ (탄산염 이온)의 형성 :
* 탄소는 4 개의 산소 원자와 4 개의 원자가 전자를 공유합니다.
* 각 산소 원자는 2 개의 전자를 얻기 위해 2 개의 전자를 얻습니다.
* 이로 인해 전체 분자에 대해 2 개의 전자의 순 이득 (3 개의 산소 원자 * 2 전자/원자 =6 개의 전자, 탄소에서 4 개의 전자를 뺀 전자 =2 추가 전자).
따라서, 탄소 원자와 3 개의 산소 원자의 전체 전하는 -2이며, 탄산염 이온 (Co₃²⁻)을 형성한다. .