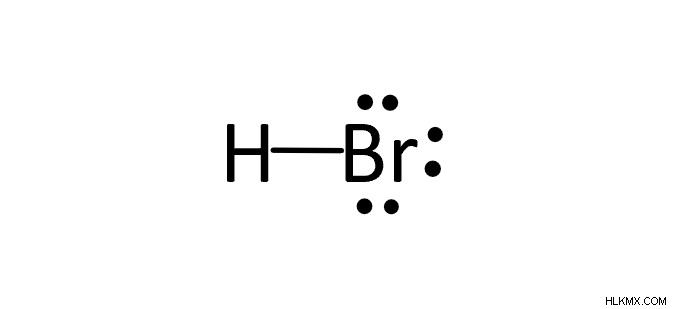핵심 개념
이 튜토리얼에서는 요소 및 화합물에 대한 올바른 Lewis Dot 구조를 그리는 방법을 배웁니다. 또한 원자가 전자 및 옥트 규칙에 대해 배울 것입니다.
다른 기사에서 다루는 주제
어휘
- 원자가 전자 :원자의 가장 바깥 쪽 쉘에있는 전자.
- 옥넷 규칙 :요소는 8 개의 원자가 전자를 선호하고 그에 따라 결합합니다.
- 그룹 번호 :주기율의 상단을 따라 실행되고 동일한 화학적 반응성이있는 원자를 포함하는 숫자.
루이스 구조는 무엇입니까?
1916 년 미국 화학자 인 Gilbert N. Lewis는 전자 점 구조에 채권 라인을 도입했습니다. 루이스 구조 또는 전자 점 구조로도 알려진이 구조는 전자가 원자 주위에 공유되고 배열되는 방식을 시각적으로 보여주는 도면입니다. 도트로 표시되는 전자는 고독한 쌍이라고하며 개별 원자에 속합니다. 선으로 표시되는 전자는 결합이며 두 원자 사이에 두 개의 전자의 공유를 보여줍니다.
루이스 도트 구조를 만드는 방법
1. 원자가 전자의 총 수를 찾으십시오.
Lewis 구조를 그려 보려면 존재하는 총 원자가 전자 수를 알아야합니다. 개별 원자에서 원자가 전자의 수는 주기율표의 원자 그룹 번호에 따라 찾을 수 있습니다. 아래는 그룹 번호를 원자가 전자에 조정하는 테이블입니다. 전이 금속 인 그룹 3-12는 4S 궤도 쉘이 만족되기 때문에 2 개의 원자가 전자를 가질 것입니다. 고귀한 가스 인 Group 18은 전체 옥틴을 가질 것입니다.
| 그룹 번호 | 1 | 2 | 3-12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 원자가 전자 수 | 1 | 2 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
둘 이상의 원자에 대한 Lewis 구조를 그리는 경우 추가해야합니다. 예를 들면 :
- o 3 =6 × 3 =18
- 산소는 원자 당 6 개의 원자가 전자를 기여합니다. 3 개의 산소 원자가 있기 때문에 18 개의 원자가 전자가 있습니다.
- naCl =1+7 =8
- 나트륨은 1 전자에 기여합니다.
- 염소는 7 개의 전자를 기여합니다.
- nh 4 =5+ (1 × 4)- (1)
- 질소는 5 개의 원자가 전자에 기여합니다.
- 수소는 4 개의 원자가 있고 각각은 1 개의 전자를 제공하기 때문에 4 개의 원자가 전자에 기여합니다.
- 마지막으로, 양전하가 있기 때문에 1 개의 원자가 전자를 빼게됩니다. 부정적이라면 1을 추가합니다.
2. 중앙 원자를 결정하십시오
존재하는 원자가 전자의 수를 알게되면 이제 중앙 원자를 결정해야합니다. 중앙 원자에는 몇 가지 주요 특성이 있습니다. 첫째, 그것은 가장 많은 결합을 만들 수있는 원자이므로 중앙에있는 데 이상적입니다. . 일반적으로 그것은 또한 원자 중 하나만 있으며 최소 전기 음성 입니다. 원자. 전기 음성성에 대한주기적인 추세를 여기에서 찾을 수 있습니다. 불소를 중앙 원자로 보지 않을 것입니다.
3. 원자 사이에 단일 결합을 형성 한 다음 나머지 전자를 원자에 고독한 쌍으로 놓습니다.
.
우리가 존재하는 원자가 전자의 수와 다른 원자에 대한 원자의 위치를 알면 단일 결합을 형성 할 수 있습니다. 각 원자에 단일 결합이 있으면 나머지 수의 원자가 전자를 원자에 배치합니다. 각 점은 전자이며 각 선은 두 개의 전자를 나타냅니다. 올바른 수의 전자를 그리는 것이 중요합니다. 올바른 양이 있는지 확인하려면 전자의 수를 세고 이전에 계산 된 총 원자가 전자와 비교하십시오.
. 4. 옥트 규칙을 준수하기 위해 전자를 주위로 이동하십시오.
이제 우리는 원자에 올바른 수의 전자를 놓았으므로 이중 또는 삼중 결합을 형성하기 위해이를 움직일 것입니다. 이것은 각 원자가 8 개의 전자로 가득 채우기를 원하기 때문에 수행됩니다. 이것을 옥틴 규칙이라고합니다. 또한 일부 원자에는 형성하고 싶은 수의 결합 수가 있습니다. 아래는 이것을 보여주는 테이블입니다.
| ATOM | 탄소 | 질소 | 산소 | flourine |
| 채권 수 | 4 | 3 | 2 | 1 |
| 고독한 쌍의 수 | 0 | 1 | 2 | 3 |
연습 예 :루이스 구조를 그리는 방법
붕소의 루이스 도트 구조는 무엇입니까?

도트를 놓을 때는 4 개의 지점이 모두 채워질 때까지 점을 별도의 측면으로 그리는 것으로 시작하십시오. 그들이 모두 채워지면 같은쪽에 더 많은 점을 추가 할 수 있습니다. 붕소에는 3 개의 원자가 전자가 있으므로 다른 측면에 3 개의 점이 있습니다
수소 브로마이드 (HBR)의 루이스 도트 구조는 무엇입니까?
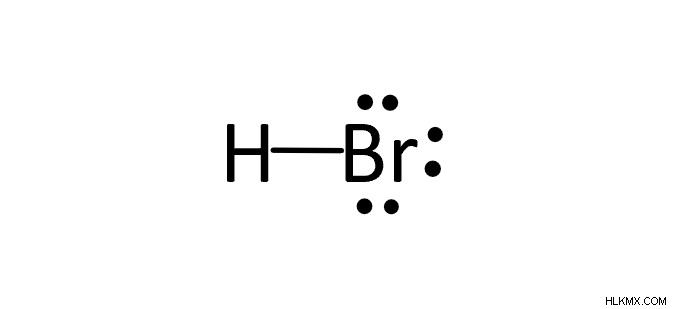
총 전자의 수는 8입니다. 수소와 브롬을 연결하는 단일 결합이 있습니다. 수소는 두 개의 전자 만 충족되므로 나머지 고독한 쌍은 브로 민으로 끝납니다.
테트라 클로라이드 탄소의 루이스 도트 구조는 무엇입니까 (CCl 4 )?
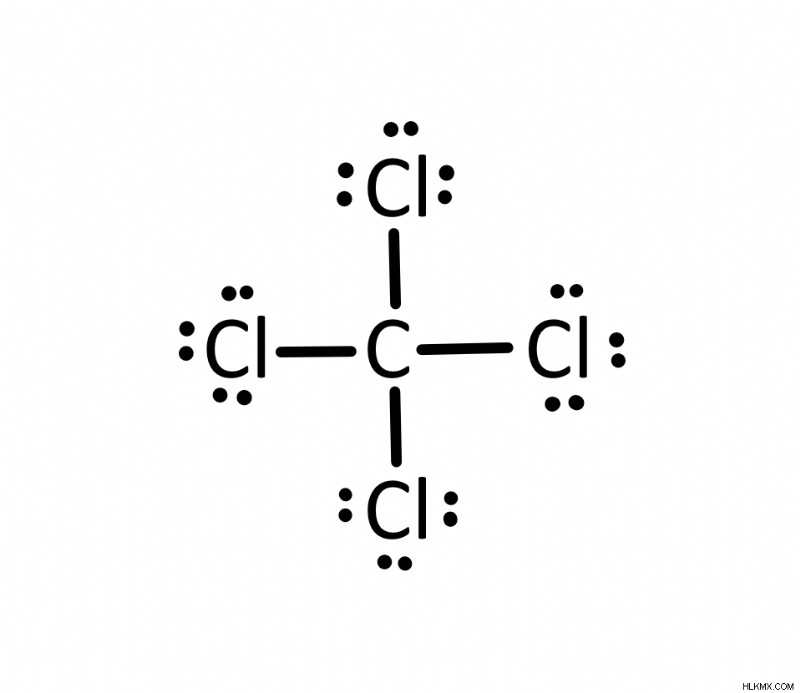
테트라 클로라이드 탄소에는 총 32 개의 원자가 전자가 있습니다. 또한, 탄소는 중심 원자가 될 것입니다. 염소에 탄소를 연결하는 4 개의 단일 결합이 있습니다. 탄소는 4 개의 결합을 가지기 때문에 옥트 규칙에 의해 만족됩니다. 나머지 전자는 염소 원자에서 끝납니다.
더 많은 예가 필요하십니까? 워크 시트는 다음과 같습니다