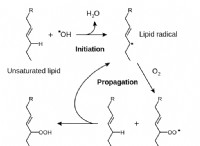
* 전방 및 역 반응의 동일한 속도 : 반응물이 생성물로 전환되는 속도는 생성물이 다시 반응물로 변환되는 속도와 정확히 동일합니다. 이는 반응물 및 생성물의 농도의 순 변화가 0임을 의미합니다.
* 일정한 농도의 반응물 및 생성물 : 개별 분자는 여전히 반응하는 반면, 반응물 및 생성물의 전체 농도는 시간이 지남에 따라 일정하게 유지됩니다.
* 동적 균형 상태 : 반응이 중단 된 것으로 보이지만 실제로는 여전히 진행 중입니다. 분자는 지속적으로 반응하지만, 순방향 및 역 반응은 동일한 속도로 발생하여 평형을 유지합니다.
* 평형 상수 (k) : 이것은 평형에서 생성물 농도 대 반응물 농도의 비율을 나타내는 특정 값입니다. K의 값은 평형에서 반응물 및 생성물의 상대적인 양을 나타내며, 다른 조건 하에서 반응의 방향을 예측하는데 사용될 수있다.
* 가역성 : 평형에서의 반응은 항상 가역적입니다. 이것은 반응이 전방 및 역 방향으로 진행될 수 있음을 의미합니다.
중요한 메모 :
* 평형은 정적 프로세스가 아니라 동적 프로세스입니다.
* 평형의 위치는 온도, 압력 또는 반응물 또는 생성물의 농도와 같은 조건을 변화시켜 이동할 수 있습니다.
* 평형은 반드시 완성과 동일하지는 않습니다. 반응은 완료되기 전에 평형에 도달 할 수 있습니다.
요약하면, 평형에서의 반응은 순방향 및 역 반응의 속도가 동일하여 일정한 농도의 반응물 및 생성물을 초래하는 동적 상태이다. 이 상태는 평형 상수와 반응의 가역성을 특징으로합니다.