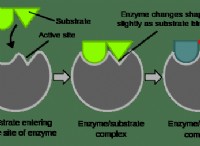
* 산화 수는 화합물에서 원자의 * 명백한 * 전하를 반영합니다. 직접 측정되지 않은 일련의 규칙에 따라 할당됩니다.
* 금속과 비금속은 결합에서 경향이 다릅니다. 금속은 전자를 잃고 양이온 (양이온)을 형성하는 경향이있는 반면, 비금속은 전자를 얻고 음이온 (음이온)을 형성하는 경향이 있습니다. 이것이 근본적인 차이입니다.
그러나 산화 숫자는 요소의 금속 또는 비금속 특성에 대한 * 단서 *가 될 수 있습니다. 방법은 다음과 같습니다.
* 금속은 일반적으로 양의 산화 수를 갖는다. 일반적으로 결합에서 전자를 잃기 때문입니다.
* 비금속은 종종 음의 산화 수를 갖는다. 그들은 전자를 얻고 음성 이온을 형성하는 경향이 있습니다.
* 일부 요소는 양수와 음의 산화 수를 모두 가질 수 있습니다. 예를 들어, 황은 h₂s에서 -2, h₂so₄에서는 +6 일 수 있습니다. 이는 황이 비금속 (전자 얻기)과 화합물 (일부 공유 결합)에서 중심 원자로 작용할 수 있음을 나타냅니다.
키 포인트 : 산화 수는 금속 대 비금속의 결정적인 지표가 아니라 결합을 이해하는 도구입니다. 요소를 결정적으로 분류하기 위해 주기성 테이블의 전기 음성 및 위치와 같은 다른 요소를 고려하는 것이 중요합니다.