살아있는 세포의 생화학 적 반응은 효소에 의해 촉매됩니다. 효소는 비활성 형태로 합성되어 이후에 활성 형태로 전환된다. 효소의 활성은 1 차 구조의 아미노산 서열에 의해 결정된다. 기질은 특정 화학 반응을 특이 적으로 가속화하기 위해 효소의 활성 부위에 결합한다. 효소의 활성 부위는 기질 결합 부위 및 촉매 부위를 포함한다. 활성 부위의 아미노산 잔기에 의해 개발 된 특정 화학 환경은 효소에 결합 할 수있는 기질을 결정합니다.
이 기사는
에 대해 설명합니다 1. 효소는 무엇이며 어떻게 작동합니까
2. 효소
3의 활성 부위는 무엇입니까? 효소와 기질은 어떻게 결합합니까?
효소는 무엇이며 어떻게 작동합니까
효소는 생물학적 촉매로서 작용할 수있는 단백질 분자입니다. 효소가 작용하는 분자를 기질이라고합니다. 특정 기질에 대한 효소의 작용에 의해 생성되는 다른 분자를 생성이라고한다. 효소는 활성화 에너지를 낮추어 생화학 적 반응을 촉진합니다. 효소에 의한 반응의 촉매는 세포에서의 특정 반응의 속도를 증가시킨다. 일부 효소는 동일한 반응을 촉매 할 수 있습니다. 그것들을 등조시임이라고합니다. 약 3,000 개의 효소의 독특한 세트는 유전자로 프로그램되어 세포에 개성을 제공합니다. 단백질 외에, 리보 자임과 같은 RNA 분자는 효소로서 작용할 수있다. 하나의 효소가 결함이되면 그 효과는 비참 할 것입니다.
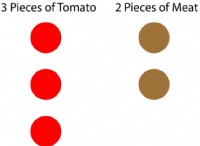
효소에는 세 가지 특징이 있습니다. 효소의 주요 기능은 반응의 속도를 높이는 것입니다. 둘째, 하나의 특정 효소는 하나의 특정 기질에서 구체적으로 작용하여 생성물을 생산한다. 셋째, 효소는 낮은 활성에서 높은 활성으로 조절 될 수 있으며 그 반대도 마찬가지입니다. 효소에 기질의 결합, 반응 속도를 높이고 생성물의 방출이 그림 1 에 제시되어 생성물을 생성한다. .
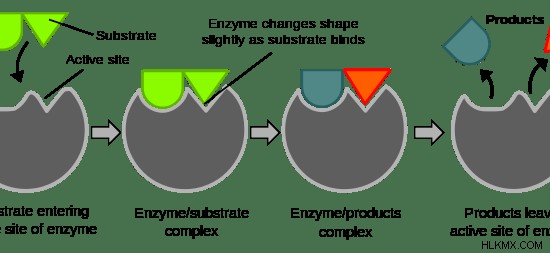
그림 1 :효소의 작용
효소의 활성은 주로 단백질 사슬의 아미노산 서열에 따라 다릅니다. 효소는 1 차 구조라고 불리는 아미노산의 선형 서열로 합성된다. 1 차 구조는 자발적으로 알파 나선 및/또는 2 차 구조라고하는 베타 시트로 구성된 3D 구조로 접 힙니다. 효소의 2 차 구조는 3 차 구조라고 불리는 소형 3D 구조로 다시 접 힙니다. 효소의 3 차 구조는 비활성 형태로 존재합니다.
효소 복합체의 폴리펩티드 또는 단백질 부분을 아포 엔자임이라고합니다. 원래 합성 구조에서 아포 엔자임의 비활성 형태는 프로 엥진 동기 또는 zymogen으로 알려져있다. 폴리펩티드 부분을 아포 엔자임으로 전환시키기 위해 몇몇 아미노산이 zymogen으로부터 제거된다. 대부분의 경우, 아포 엔자임은 반응을 촉진하기 위해 보조 인자라는 다른 화합물과 결합됩니다. 아포 엔자임과 보조 인자의 조합을 홀로 엔자임이라고합니다. 아포 엔자임, 보조 인자 및 홀로 엔자임 사이의 관계는 그림 2 에 나와 있습니다. .
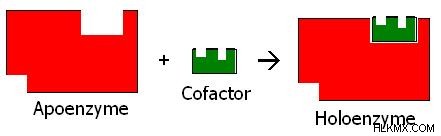
그림 2 :아포 엔자임, 보조 인자 및 홀로엔자임
효소의 활성 부위는 무엇입니까
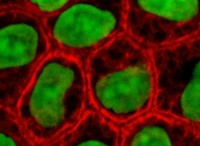
효소의 활성 부위는 특정 기질이 효소에 결합하여 화학 반응을 촉진하는 영역입니다. 촉매 부위와 함께 기질 결합 부위는 효소의 활성 부위를 형성한다. 효소는 어떤 식 으로든 기질을 변화시키는 화학 반응을 촉진하기 위해 특정 기질과 결합한다. 기질은 효소보다 크기가 작습니다. 기판은 활성 부위에 의해 효소 내부에서 완벽하게 배향된다. 하나 이상의 기질 결합 부위는 효소에서 발견 될 수있다. 촉매 부위는 결합 부위 옆에서 발생하여 촉매를 수행합니다. 촉매에 관여하는 약 2 ~ 4 개의 아미노산으로 구성됩니다. 활성 부위를 형성하는 아미노산은 효소의 아미노산 서열의 별개의 부분에 위치한다. 따라서, 효소의 1 차 구조는 3D 구조로 접어 활성 부위가 함께 모일 수 있도록해야한다. 효소의 활성 부위 인 리소자임은 그림 3 에 나와 있습니다. . 기판 인 Peptidoglycan은 검은 색으로 표시됩니다.
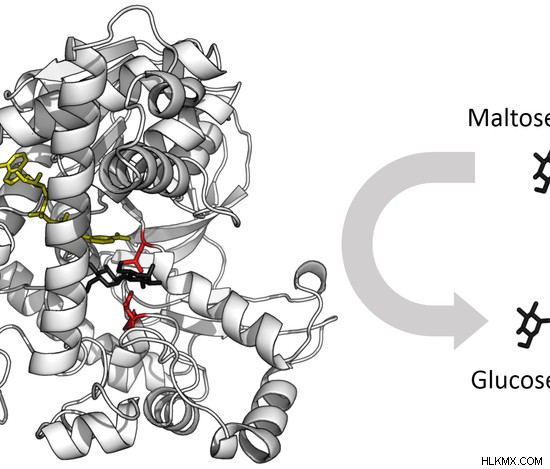
그림 3 :효소의 활성 부위
활성 부위와 구별되는 효소에는 이펙터 분자에 결합하여 효소의 형태 또는 역학을 변화시키는 포켓이 포함되어 있습니다. 이 주머니는 효소의 반응 속도의 알로 스테 릭 조절에 관여하는 알로 스테 릭 부위로 알려져 있습니다.
효소와 기질이 어떻게 결합하는지
효소의 결합 부위는 기판-특이 적 방식으로 기질과 결합합니다. 이 결합은 촉매제의 기질을 orients 다. 효소의 결합 부위에 위치한 아미노산 잔기는 약한 산성 또는 염기성 일 수있다; 친수성 또는 소수성; 긍정적 인 차전, 음전 차전 또는 중립. 결합 부위 내에서 생성 된 매우 구체적인 화학 환경은 효소의 특이성을 결정합니다. 반 데르 발스 힘, 친수성/소수성 상호 작용 또는 수소 결합과 같은 임시 공유 상호 작용은 기질과 활성 부위에 의해 형성된다. 기질과 함께 효소와 함께 효소는 효소--서스트 레이트 복합체를 형성한다.
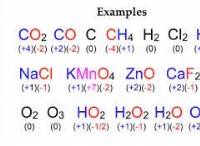
효소에 대한 기질의 결합은 두 가지 메커니즘의 잠금 및 키 모델과 유도 된 적합 모델로 발생할 수 있습니다. 잠금 및 키 모델 기질은 하나의 순간 단계에서 효소와 정확히 맞는다 고 주장한다. 결합은 효소의 구조를 약간 변화시킨다. 올바른 크기와 모양의 기판만이 잠금 및 키 모델에서 효소와 결합 할 수 있습니다. 유도 적합 모델 동안 , 효소의 활성 부위의 형태는 기질 결합에 반응하여 지속적으로 변화한다. 이것은 다른 분자가 효소의 활성 부위에 결합하는 이유를 설명합니다. 그러나, 효소에 대한 기질의 이러한 동적 결합은 기질을 안정화시키고 생화학 적 반응의 속도를 증가시킨다. 헥소 키나제는 기질, 아데닌 트리 포스페이트 및 자일 로스의 형태에 맞는 형태를 변화시키는 효소입니다. 헥소 키나제의 유도 된 적합 모델은 도 4 에 나와 있습니다. . 결합 부위와 기판은 파란색과 검은 색으로 표시됩니다.
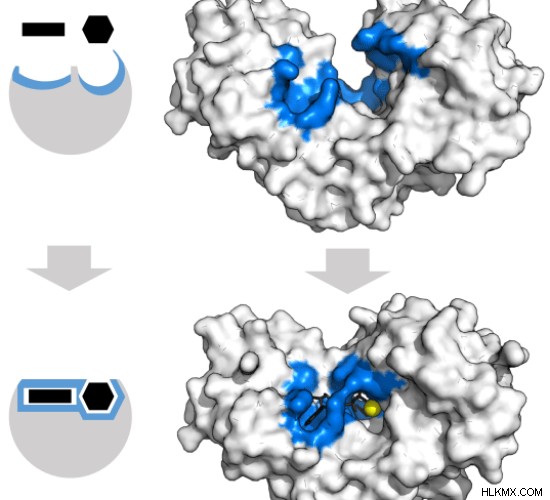
그림 4 :헥소 키나제의 유도 된 적합 모델
효소에 의한 화학 반응의 촉매는 화학 반응의 활성화 에너지를 낮추는 여러 가지 방법으로 발생할 수 있습니다. 먼저, 효소는 전이 상태의 상보 적 전하 분포를 생성함으로써 전이 상태를 안정화시켜 에너지를 낮 춥니 다. 둘째, 효소는 원래 전이 상태의 에너지에 대한 에너지가 낮은 제 2 전이 상태를 함유하는 대안적인 반응 경로를 촉진한다. 셋째, 효소는 기질의지면 상태를 불안정하게한다.
결론
효소는 살아있는 세포에서 생화학 적 반응의 속도를 증가시키는 화학 반응입니다. 대부분의 효소는 일차 구조에서 합성 된 단백질입니다. 이들 아미노산 사슬은 3D 구조로 접어 활성 형태의 효소를 생성한다. 이 폴딩은 활성 부위라고 불리는 효소에 포켓을 만듭니다. 기질은 효소의 활성 부위에 구체적으로 결합하여 신체에서 발생하는 생화학 적 반응의 속도를 증가시킨다.
. 참조 : 이미지 제공 :
1. 효소. N.P., N.D. 편물. 2017 년 5 월 21 일.
2. enzymes와 활성 사이트.” 칸 아카데미. N.P., N.D. 편물. 2017 년 5 월 21 일.
3. enzyme 활성 부위 및 기질 특이성.” 무한한. 2016 년 11 월 17 일. 웹. 2017 년 5 월 21 일.
1. Timvickers에 의해 생성 된“유도 적합 다이어그램”, fvasconcellos에 의해 벡터화 - Commons Wikimedia
2를 통해 Timvickers (Public Domain)가 제공합니다. Thomas Shafee의“효소” - Commons Wikimedia
3을 통한 자신의 작업 (CC 4.0). Thomas Shafee의“효소 구조” - Commons Wikimedia
4를 통한 자신의 작업 (4.0). Thomas Shafee의 "Hexokinase 유도 적합성" - Commons Wikimedia를 통해 자신의 작업 (CC 4.0)