기본
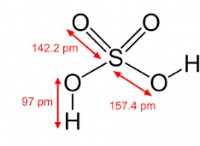
* pH : 용액의 산도 또는 알칼리도 측정. 그것은 히드로 늄 이온의 농도 (H₃O⁺)에 기초합니다.
* 히드로 늄 이온 (h₃o⁺) : 이 이온은 물의 산성 특성을 담당합니다.
* 수산화 이온 (OH태) : 이 이온은 물의 기본 (알칼리성) 특성을 담당합니다.
관계
* 물의 자동 이온화 : 순수한 물은 매우 약간의 이온화를 겪고 동일한 양의 h ₃O⁺ 및 oh 이온을 만듭니다. 이것은 평형으로 표시됩니다.
2h₃o ⇌ h₂o⁺ + oh⁻
* pH 스케일 : pH 척도는 0에서 14 사이입니다.
* pH <7 : 산성 용액은 OH⁻보다 농도가 높습니다.
* pH =7 : 중성 용액은 동일한 농도의 H₃O⁺ 및 OH를 갖습니다.
* pH> 7 : 기본 (알칼리성) 솔루션은 HATER보다 높은 농도의 OH ⁻를 갖는다.
수학적 관계
pH, HATERANCESS 농도 및 OHAL 농도 사이의 관계는 다음 방정식에 의해 정의됩니다.
* pH =-log₁₀ [h₃o⁺]
*이 방정식은 pH와 h₃O⁺ 농도 사이의 직접적인 관계를 보여줍니다. HATE 농도가 높을수록 pH가 더 낮다 (산성).
* poh =-log₁₀ [oh⁻]
*이 방정식은 POH (알칼리도의 척도)를 OH태 농도와 관련시킵니다.
* ph + poh =14
*이 방정식은 pH와 POH 사이의 역 관계를 강조합니다. 하나는 증가함에 따라 다른 하나는 감소합니다.
키 포인트
* 역 비례 : h ofo⁺의 농도가 증가함에 따라 OH ⁻의 농도는 감소하고 그 반대도 마찬가지입니다.
* 중성수 : 순수한 물은 7의 pH를 가지며, 이는 [h₃o⁺] =[OH⁻] =10 ℃를 의미합니다.
* 로그 척도 : pH 척도는 로그인데, 이는 pH의 1- 단위 변화가 HATEBO 농도의 10 배 변화를 나타낸다는 것을 의미한다.
예
용액에서의 h₃o⁺ 농도가 10 ℃ 인 경우 :
* pH =-logl (10 ℃) =5
*이 용액은 산성입니다 (pH <7).
PH, HATER 또는 OH태의 특정 측면을보다 자세히 살펴보고 싶다면 알려주십시오!