당신은 지금까지 산과 염기에 대해 읽었습니다. 바라건대, 당신은 산과 염기를 포함한 많은 실험을 발견 할 것입니다. 따라서 귀하는 또한 그들의 속성을 알고 있습니다. 같은 순서로 황산에 대한 실험을 했습니까? 선생님이 왜 농축 된 산에 물을 첨가하지 못하게했는지 궁금한 적이 있습니까? 황산도 집에서도 사용된다는 것을 알고 있습니까?
다음 섹션에서는 황산, 특성 및 그 용도에 대해 자세히 알아볼 수 있습니다.
황산이란 무엇입니까?
유황은 h₂so₃, h₂s₂o₃, h₂s₂o₄, h₂so₅ 등과 같은 많은 옥소 산을 형성합니다. 그중 일부는 안정적이고 일부는 불안정하고 분리 할 수 없습니다. 이 황의 옥소 세포는 수성 형태 또는 그들의 염의 형태로 존재합니다.
황산은 그 중 하나입니다. 황의 모든 옥소 세포 중에서 가장 중요한 산입니다. 황산은 때때로 디 하이드로 겐 설페이트, 유리체 오일, 매트 링 산, 배터리 산, 디핑 산 및 황산 사용에 따라 많은 다른 이름으로도 알려져 있습니다. 고대 시절, 황산은 녹색 vitriol (철 황산염), feso₄.7h₂o.
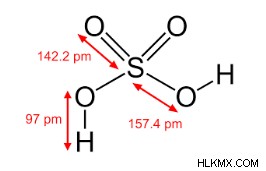
황산의 구조
그것은 dibasic acid이므로 두 개의 OH 그룹을 포함합니다. 이 두 그룹은 S-Atom에 직접 연결됩니다. 따라서, 황산, H₂SOA는 또한 공식 (OH) ₂ SOA에 의해 표현 될 수있다. 2 개의 OH 그룹의 존재는 H ₂소 ₄가 PCL₅과 반응 할 때, H ₂소 분자에 존재하는 2 개의 OH 그룹이 2 개의 Cl- 원자로 대체된다는 사실에 의해 검증된다. 결과적으로, 염산 황 (Cl ₂SOA)이 얻어진다. 다른 많은 반응은 h₂so₄의 구조에서 S-Atom에 직접 부착 된 두 개의 OH 그룹의 존재를 확인할 수 있습니다.
이러한 사실에 근거하여, 두 개의 이중 결합이 있고 다른 하나는 두 개의 좌표 결합을 갖는 두 가지 구조가 있습니다.
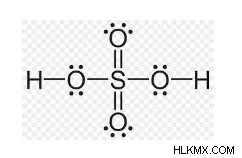
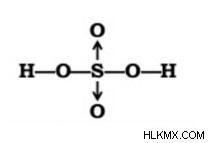
HASSO₄ 분자 의이 두 구조는 공명 상태를 유지한다고 가정합니다. 황산은 사면체 구조를 가지고 있으며, 여기서 황은 +6의 산화 상태로 하이브리드 화 된 Sp³입니다.
황산 제조
오늘날, 황산의 제조는 두 가지 과정을 사용합니다. 이것들은
입니다1. 리드 챔버 프로세스 :
이 과정에서, 황산은 SO₂, 공기 및 NO의 혼합물이 증기 (h₂O)로 처리 될 때 형성된다. 이 과정에서 촉매로 작용하지 않습니다.
화학 반응은
로 발생합니다2SO from + O₂ (공기에서) + 2H₂O + [NO] → 2H₂So₄ + [NO]
2. 연락처 :
이 과정에는 다음 단계가 포함됩니다.
- 1 단계 : so <의 준비.
s + o₂ → so₂
- 2 단계 : so₂에 대한 산화
2SO⇌ + o ₂ ₂ 2SO₃
이 반응은 촉매의 존재하에 일어난다. PT-Asbestos, v₂o₅ 또는 fe₂o₃.
일 수 있습니다- 3 단계 : 98% h₂so₄에서 So 9의 용해.
So₃ + h₄so₂ → h₂s₂o₇
- 4 단계 : 물에 의한 올레움 희석.
h₂s₂o₇ + h₂o → 2h₂so₄
황산의 물리적 특성
- 순수한 황산은 무색, 밀도가 높고 무겁고 시럽 유성 액체입니다.
- 15 °에서 1.84의 밀도가 있습니다.
- 비등점은 340 ℃이며, 무색의 결정은 10.38 ℃에서 녹입니다.
- 황산 분자 사이의 H- 결합은 높은 비등점과 점도를 보여줍니다.
- 물에 매우 용해됩니다. 그리고 물이 첨가되면 매우 발열 반응을 보여줍니다.
- 그것은 전기와 열의 품질 지휘자입니다.
- 조직과 금속에 매우 부식성이 있습니다. 따라서 피부의 황산은 화상을 생성합니다.
- 접촉시 목재와 기타 유기 물질을 태우지 만 화재를 일으키지는 않습니다.
- 고농도의 황산은 흡입으로 인한 심각한 건강에 영향을 줄 수 있습니다.
황산의 화학적 특성
1. 해리 :
가열되면 h₂so₂는 증기 (h₂o) 및 so₃에 분리를 겪습니다.
h₂so₂ ⇌ h₄o + so₃
2. 산성 성질 :
산의 수용액은 2 단계로 이온화되기 때문에 강한 디바 산으로서 작용하고 2 개의 h⁺ 이온을 제공하기 때문이다. 예를 들어,
h₂so₂ ⇌ 2h⁺ + so₄⁻
3. 산화제 :
뜨거운 농축 황산은 강력한 산화제 역할을합니다. 그것은 h₂so₄가 초기 산소를 상당히 쉽게 잃을 수있는 이유 때문입니다. HASSO태가 어떤 물질을 산화시킬 때, 그것은 SO₂로 감소됩니다. 이러한 산화 특성은 희석 h ₂소
에서는 불가능합니다.h₂so₂ → h₄o + so₂ + [o]
4. 탈수제 :
농축 된 hoyso₄는 물에 용해되고 황산 수화물, H₂So₄.nh₂o를 형성한다. 이 특성으로 인해 농축 된 H₂So₄는 탈수 특성을 보여줍니다. 예를 들어,
(COOH)) + h₂so₄ → co + co₂ + [h₂so₄.h₂o]
5. 강수 반응 :
칼슘, 바륨, 납 등의 수용액이 희석 된 h ₂소로 처리되면, 상응하는 금속 황산염의 백색 침전물이 형성됩니다. 예를 들어,
bacl₄ + h₂so₂ → baso₄ ↓ + 2hcl
6. 전기 분해 :
50% h₄SO₂가 전기 화 될 때, 용액의 양극에서 퍼 옥시 디 설 푸르 산 (h₂s₂o₈)이 얻어진다.
7. 소금에 대한 행동 :
H ₂소는 탄산염, 황산염, 질산염, 염화물 등과 같은 더 휘발성 산의 염을 분해하는 강산입니다. 예를 들어,
2NACL + HASSOAT → NAISOAT + 2HCL
중화 황산
중화 황산 공정은 훌륭한주의와 예방 조치로 수행되어야합니다. 아래에 주어진 단계를 따라갈 수 있습니다. 이들은 황산을 중화시키는 데 도움이 될 수 있습니다.
- 황산이 쏟아지는 곳에 베이킹 소다를 붓습니다.
- 농축 황산 영역에 물을 첨가하지 마십시오. 조건이 악화 될 것입니다.
- 황산을 중화 시키려면 Naoh와 같은 강한 염기를 사용하십시오. 그러나 더 큰 유출을 유발할 수 있으므로 솔루션을 사용하지 마십시오.
- 유출 부위에 충분한 으깬 얼음을 부어 넣으십시오.
- 옷에 쏟아져 나오면 가능한 빨리 제거하여 흐르는 물 아래로 씻으십시오.
황산 사용
황산은 다양한 목적으로 산업뿐만 아니라 가정에서도 사용됩니다. 황산의 다양한 용도로 인해 종종 '화학 물질의 왕'이라고 불립니다. 황산의 상업적 사용 중 일부는
입니다.- (nh₄) ₂ ₂소, 비정질, 암모전 인산화 황산염, 석회의 과인산, k ₂소 등과 같은 다양한 비료를 제조하는 데 사용됩니다.
- 그것은 HCl, h₃po₄, hno₃ 등과 같은 다른 산을 제조합니다.
- 니트로 글리세린, 트리 니트로 톨루엔 (TNT), 피크 산, 총 면화, 다이너마이트 등과 같은 폭발물 제조에 사용됩니다.
- 황산은 명반, 금속 황산염, 에테르, 인, Na로 코스 등과 같은 많은 화학 물질을 제조합니다.
- 그것은 석유의 정제에 사용됩니다.
- 금속 정화를 위해 많은 야금 과정에서 사용됩니다.
- 황산은 콜 타르, 염료 및 여러 약물 및 소독제를 제조하는 데 도움이됩니다.
- 그것은 섬유, 종이 및 염색 산업에 도움이됩니다.
- 선탠의 가죽 산업에 도움이됩니다.
- 전기 도금, 에나 멜링, 아연 도금 등의 금속을 청소하는 데 사용됩니다.
- 저장 배터리에 사용됩니다.
황산은 가정에서 사용됩니다
상업적 목적으로 황산은 집에서 사용됩니다. 가정에서의 일반적인 황산 사용 중 일부는
입니다.- 그것은 자동차 배터리에서 발견됩니다.
- 일부 배수 청소기에 사용됩니다.
- 그것은 가루 세탁소 핸드 비누, 세제, 애완 동물 제품 및 식기 세척 액체의 첨가제입니다.
- 그것은 알루미늄 청소 제품과 같은 가정용 청소 제품에서 일반적으로 발견됩니다.
결론
황산은 가장 흔한 산입니다. 다양한 화학 실험, 산업 및 가정에서 고도로 사용됩니다. 거의 모든 산업에서 요구하는 다양한 화합물을 만드는 데 사용됩니다. 강한 무인산입니다.
조심스럽게 사용하면 유익 할 수 있습니다. 그러나 예방 조치가 없으면 당신에게 해로울 수 있습니다. 심각한 건강 문제를 일으키거나 심지어 사망으로 이어질 수도 있습니다. 따라서 적절한 관리와 예방 조치와 전문가의 감독하에 사용하는 것이 좋습니다.
자주 묻는 질문
1. 황산의 해로운 영향은 무엇입니까?
- 황산의 해로운 영향 중 일부는 입니다
- 황산 (H₂So₄)은 눈, 피부, 폐 및 치아에 파괴적인 부식성 물질입니다.
- 급성 노출로 인해 사망이 발생할 수 있습니다.
- 농축 된 h₂so₄는 많은 화학 물질과 접촉 할 때 불을 피우거나 폭발 할 수 있습니다.
2. 황산에 물이 첨가되면, 공정은 발열이된다. 왜?
A. 물이 산에 부어지면 많은 양의 열이 생성됩니다. 따라서 온도는 120 °로 상승합니다. 생성 된 열이 너무 커서 산이 용기 밖으로 튀어 나옵니다. 따라서 산이 희석되면 산에 물이 아닌 일정한 교반으로 천천히 물에 첨가해야합니다.
3. 황산에 노출 될 위험이있는 노동자는 어떤 곳에서?
A. 근로자가 위험에 처한 곳 중 일부는
- 기계공
- 야외 노사들은 석유, 석탄 또는 가스가 연소되는 지역에서 일합니다.
- 인쇄, 출판 또는 사진 상점의 직원.
- 물과 혼합 된 화장실 냄비 청정기와 관련하여 계약자 및 배관공.
- 산성 안개에 노출 된 철강 노동자 및 소방관.
4. 피부의 황산은 무엇을 유발합니까?
A. 피부에 대한 황산의 영향은 다음과 같습니다.
- 통증, 화상, 발적 및 물집을 유발할 수 있습니다.
- 피부에 많은 양의 황산이 영구적 인 흉터를 초래할 수 있습니다.
- 심하게 노출되면 사망을 유발할 수도 있습니다.
- 피부 접촉 후 건조하고 빨간색, 금이 간 피부 (피부염)를 유발할 수 있습니다.







