이유는 다음과 같습니다.
* 염화 칼륨은 소금입니다. 그것은 안정적인 화합물이며 산소를 방출하는 데 쉽게 분해되지 않습니다.
* 산소 제조는 일반적으로 분해 반응을 포함합니다. 우리는 염소산 칼륨 (Kclo₃), 과산화수소 (HATE) 또는 물의 전기 분해와 같은 화합물을 사용하여 산소를 얻습니다.
산소 제조를위한 일반적인 실험실 방법 :
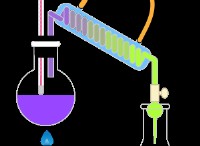
1. 염소산 칼륨의 분해 (kclo₃) :
- 이것은 고전적인 방법입니다. 염소산 칼륨은 이산화 망간 (MNO₂)과 같은 촉매의 존재하에 가열 될 때 염화 칼륨과 산소 가스로 분해됩니다.
- 방정식 :2kclo₃ → 2kcl + 3o₂
2. 과산화수소의 분해 (HATER) :
- 과산화수소는 이산화 망간과 같은 촉매의 존재하에 물과 산소 가스로 분해됩니다.
- 방정식 :2ho₂ → 2h₂o + o₂
3. 물의 전기 분해 :
- 물을 통해 전류를 통과하면 수소와 산소 가스로 분리됩니다.
- 방정식 :2H 2O → 2H₂ + O₂
요약 :
염화 칼륨은 실험실에서 산소를 제조하기에 적합한 출발 물질이 아닙니다. 산소 가스를 생성하기 위해 쉽게 분해되거나 전기 분해를받는 화합물을 사용해야합니다.