순 이온 방정식을 작성하려면 먼저 수성 참가자를 구성 이온으로 분해 한 다음 방정식의 양쪽 (관중 이온)에 존재하는 이온을 제거해야합니다.
얼마 전, 우리는 균형 잡힌 화학 방정식을 작성하는 방법에 대해 논의했습니다. 오늘, 노치를 차고 순 이온 방정식을 쓰는 방법을 배우겠습니다.
기본 화학 방정식에는 완전한 분자 형태의 반응물 및 생성물이 포함됩니다. 반면에 이온 성 방정식은 반응과 관련된 수성 성분을 구성 이온으로 분해합니다. 순 이온 방정식은 이것을 한 단계 더 발전시키고 반응에 직접 참여하고 관중 이온을 도랑하는 이온과 분자 만 포함합니다.

이온 방정식은 완전한 분자 형태보다는 수용액의 이온을 통합합니다. (사진 크레딧 :Erika J Mitchell/Shutterstock)
이온 방정식을 쓰는 방법?
이온 성 방정식을 작성하기 전에 이온 성 화합물이 무엇인지, 어떻게 작동하는지 알아야합니다.
이온 성 화합물은 정전기력에 의해 함께 유지되는 반대로 하전 된 이온 (순 전하가있는 분자)으로 구성됩니다. 이들 화합물은 적절한 용매에 용해 될 때 성분 이온으로 분리된다. 물이 용매로 사용될 때, 용액을 수용액이라고합니다 (물은 매우 우수한 용매이며 대부분의 이온 성 화합물에 작용합니다). 이 솔루션이 첨자 aq 로 표시된 것을 보았을 것입니다. 화학 방정식에서.
해리 된 이온은 계속해서 다른 반응물의 이온과 반응하여 최종 생성물을 생성합니다.
그러나 일부 이온은 화학 방정식의 양쪽에 존재하며 반응에 직접 참여하지 않습니다. 이 이온은 관중 이온으로 알려져 있습니다 (나중에 더 자세히 설명)
이제 순 이온 방정식을 쓰는 방법을 배우자.
1 단계 :화학 방정식의 균형.
순 이온 방정식은 균형 잡힌 화학 방정식에서 파생되므로 진행하기 전에 균형 잡힌 화학 방정식이 필요합니다.
.화학 방정식의 균형을 유지하려면 방정식의 양쪽에 각 요소의 원자 수를 계산하여 시작하십시오. 모든 원자가 설명되면 1 차 요소의 균형을 잡은 다음 수소와 산소 원자가.
화학 방정식의 균형을 유지하는 방법에 대한이 간단한 개요는 클릭하지 않으면이 주제에 대한 자세한 내용을 확인하십시오. 균형 잡힌 화학 방정식을 작성하는 방법
예를 들어, 염화 칼륨의 납 반응에 대한 균형 화학적 방정식은 다음과 같습니다.
2KCL + PB (NO3) 2 → 2KNO3 + PBCL2
2 단계 :모든 반응물 및 제품의 물리적 상태를 결정합니다
이제 우리는 각 참가자 반응물과 제품의 물리적 상태를 방정식에서 식별해야합니다. 이를 위해, 우리는 주기율표와 용해도 테이블을 사용합니다. 용해도 테이블은 다양한 음이온과 양이온 과이 두 입자의 조합이 물에서 어떻게 행동하는지 표시합니다.
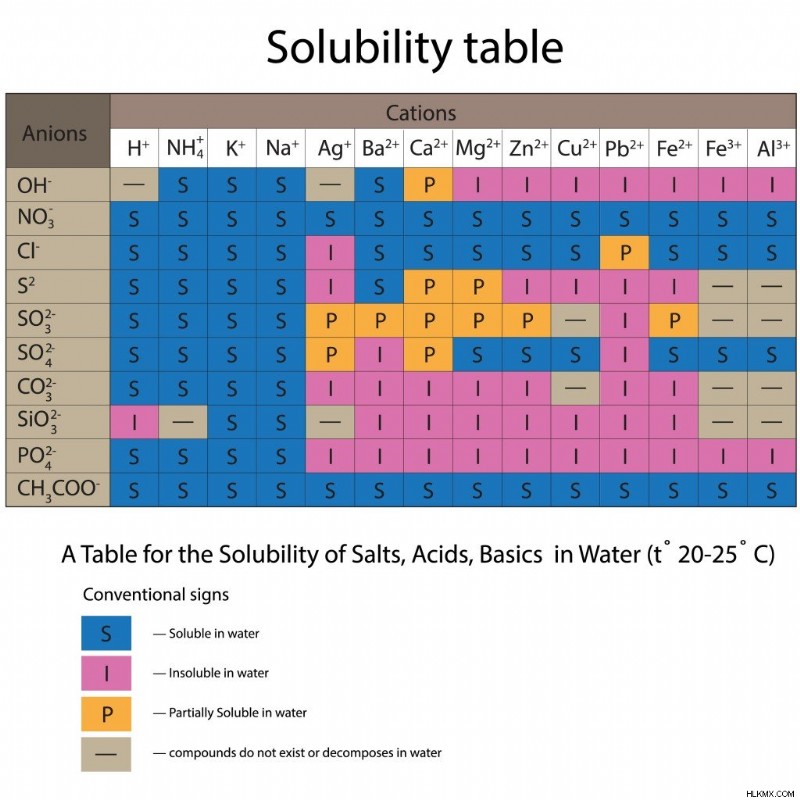
물의 다양한 음이온 및 양이온에 대한 용해도 테이블. (사진 크레딧 :Yaruna/Shutterstock)
문제 문서에서 명확하지 않은 경우,주기 테이블을 참조하여 참가자의 물리적 상태를 원소 형식으로 얻으십시오. 화합물 (및 염)의 경우 용액에 포함 된 경우 용해도 테이블에서 용해도를 확인하는 것으로 시작하십시오. 그들이 용해한다면, 계속해서 그들의 상태를 수성으로 씁니다. 화합물이 용해되지 않으면 고체 상태에 있어야합니다. 또한 반응에 관련된 산 또는 염기는 수성입니다.
용해도 테이블에서, 우리는 K+ 양이온이 Cl- 및 NO3- 음이온 둘 다로 물에 용해되어 있음을 알 수 있습니다. 따라서, 화합물 KCl 및 KNO3은 수성이다. PB2+ 양이온의 경우, 이들은 NO3 - 음이온이 수용성이지만 Cl- 음이온과 부분적으로 만 용해됩니다. 따라서, PB (No3) 2는 수성이고 PBCL2는 고체로 존재한다.
각 반응물과 제품의 물리적 상태로 균형 화학적 방정식을 작성하면 다음과 같습니다.
2KCL (AQ) + PB (NO3) 2 (AQ) → 2KNO3 (AQ) + PBCL2 (S)
3 단계 :수성 화합물을 구성된 이온으로 분해
이온 성 방정식을 작성하려면 이제 수성 화합물을 성분 이온으로 분해해야합니다. 수성 화합물을 분해하는 것을 기억하십시오. 이들은 물에 용해되어 성분 이온으로 분할되므로. 비 퀴즈 참가자를 그대로 두십시오.
예제와 관련하여 KCl은 K+ 및 Cl – 이온으로 분할되고 PB (No3) 2는 반응물 측면에서 PB2+ 및 2NO3로 분해됩니다.
.제품 측면에서 KNO3은 K+ 및 NO3- 이온으로 분리됩니다. 솔리드로서, pbcl2는 그대로 유지됩니다.
2k + (aq) + 2Cl– (aq) + pb2 + (aq) + 2no3 - (aq) → 2k + (aq) + 2no3 - (aq) + pbcl2 (s)
참고 : 각 이온에 균형 화학적 방정식에 부착 된 화학량 론 계수에 각 이온에 곱하는 것을 잊지 마십시오. 그렇게하지 않으면 이온과 충전이 불균형을 남길 것입니다.
4 단계 :관중 이온을 제거하십시오
이제 마지막 단계와 순 이온 방정식을 작성하려면 스펙터 이온을 제거하기 만하면됩니다. 앞에서 언급했듯이, 이온 성 화합물이 이온에 분리 될 때, 그중 일부만이 다른 이온과 반응하여 생성물을 형성하는 반면, 다른 일부는 앉아서 반응하는 것을 지켜보십시오. 스포츠 행사의 관중과 마찬가지로,이 이온은 반응에 직접 참여하지 않고 단지 관중 이온이라고 불립니다. 다른 이온과 반응하여 생성물을 형성하는 이온은 주요 이온 또는 플레이어 이온이라고 할 수 있습니다.

관중과 유사한 관중 이온은 화학 반응에 참여하지 않습니다.
스펙터 이온은 반응물 측면과 화학 방정식의 생성물 측면에서 변경되지 않은 것으로 보인다. 가장 일반적인 관중 이온 중 일부는 주기율표 (K+ &Na+)의 첫 번째 컬럼의 알칼리 금속과 Cl -&f–와 같은 할로겐을 포함합니다. 이 이온이 반응에 참여하지 않기 때문에 평형에도 영향을 미치지 않습니다.
염화 칼륨과 질산 납의 반응을 위해, K+ 및 NO3 -이온이 존재하고 양쪽에 변하지 않았다; 이들은 관중 이온입니다. 이온 Cl -및 PB2+는 최종 생성물 PBCL2를 형성하며 플레이어 이온입니다. K+ 및 No3을 취소하고 나머지 참가자와 함께 방정식을 다시 작성하여 순 이온 방정식을 얻습니다.
2k+ (aq) + 2Cl- (aq) + pb2 + (aq) + 2no3 - (aq) → 2k+ (aq) + 2no3 - (aq) + pbcl2 (s)
방정식을 다시 쓰면 다음과 같습니다.
2Cl- (aq) + pb2 + (aq) → pbcl2 (s)
반응물을 재정렬 한 후, 방정식은 다음과 같습니다.
pb2 + (aq) + 2Cl- (aq) → pbcl2 (s)
위의 방정식은 염화 칼륨의 납 반응을위한 순 이온 방정식이라고하며, 이는 염화 칼륨을 1 차 생성물로 생성합니다.
.최종 단어
그 자체로 순 이온 방정식을 작성하는 것은 어렵지 않지만 다양한 주제에 대한 지식이 필요합니다. 여기에는 수성 용액, 이온 성 화합물, 다양한 화합물의 용해도 및 용해도 테이블 사용 방법이 포함됩니다.
.이 과정의 시작 부분에서 잘못된 균형 잡힌 화학 방정식은 확실히 잘못된 경로를 안내합니다. 따라서 완벽하게 균형 잡힌 화학 방정식으로 시작하십시오.
마찬가지로, 이온 형태를 쓸 때, 이온의 수와 그 전하가 방정식의 양쪽에서 균형을 잡기 전에 관중 이온이 최종 이온 방정식에 도달하기 위해 균형을 잡습니다.