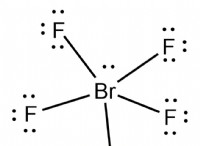
해리 이해
수산화 칼슘 (Ca (OH) ₂)는 다음 평형에 따라 물에 용해됩니다.
Ca (OH) ₂ (S) ⇌ ⇌ Ca²⁺ (aq) + 2oh⁻ (aq)
몰비
균형 방정식은 용해되는 1 몰의 Ca (OH) ₂에 대해 1 몰의 Ca²⁺ 및 2 몰의 OH ⁻가 생성된다는 것을 보여준다.
농도 계산
* [Ca²>] : 포화 용액의 밀도는 0.0125m이기 때문에, Caentl의 농도는 0.0125 m 입니다. .
* [OH태] : OH⁻의 농도는 Ca²⁺의 두 배이므로 0.0250 m 입니다. .
요약
몰토리성 0.0125 m의 수산화 칼슘의 포화 용액에서 :
* [Ca² =] =0.0125 m
* [OH⁻] =0.0250 m