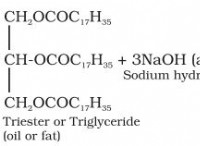공유 화합물 :공유는 돌보고 있습니다!
공유 화합물은 둘 이상의 비금속 에 의해 형성된다 안정적인 전자 구성을 달성하기 위해 전자를 공유하십시오. 이 공유는 공유 결합 의 형성을 초래한다 이온 성 화합물을 함께 유지하는 약한 힘보다 훨씬 강합니다.
공유 화합물의 몇 가지 주요 특성은 다음과 같습니다.
비금속 사이에 형성된 * : 그들은 일반적으로 산소, 탄소, 질소 및 수소와 같은 주기율표의 오른쪽에서 요소를 포함합니다.
* 전자 공유 : 이온 결합과 같은 전자를 전달하는 대신, 공유 화합물의 원자는 전자를 공유하여 완전한 외부 쉘을 달성합니다.
* 낮은 용융 및 끓는점 : 공유 화합물은 종종 이온 성 화합물에 비해 용융점 및 끓는점이 더 낮아서 약한 힘이 함께 유지됩니다.
* 전기 지휘자 : 공유 화합물은 일반적으로 자유롭게 움직이는 하전 입자가 없기 때문에 고체 또는 액체 형태로 전기를 전도하지 않습니다.
* 는 고체, 액체 또는 가스로 존재할 수 있습니다 : 공유 화합물의 물리적 상태는 분자간 힘의 강도에 의존합니다.
* 분자 구조 : 공유 화합물은 별개의 분자로서 존재하며, 결합의 수 및 유형에 의해 결정된 원자의 특정 배열이 존재한다.
공유 화합물의 예 :
* 물 (h>o) : 2 개의 수소 원자는 산소 원자와 전자를 공유합니다.
* 이산화탄소 (Co₂) : 탄소는 두 개의 산소 원자와 전자를 공유합니다.
* 메탄 (ch₄) : 탄소는 4 개의 수소 원자와 전자를 공유합니다.
* 포도당 (c₆h₁₂o₆) : 탄소, 수소 및 산소 원자 사이의 공유 결합에 의해 형성된 복잡한 유기 분자.
공유 결합의 본질 이해 :
공유 결합은 인접 원자의 원자 궤도가 겹치면 전자를 공유 할 수있을 때 형성됩니다. 이 공유는 원자 사이에 높은 전자 밀도의 영역을 생성하여 함께 유지합니다.
공유 결합 유형 :
* 단일 본드 : 원자는 한 쌍의 전자를 공유합니다.
* 이중 채권 : 원자는 두 쌍의 전자를 공유합니다.
* 트리플 본드 : 원자는 3 쌍의 전자를 공유합니다.
공유 화합물은 우리 세계에서 중요한 역할을합니다. 그들은 유기 화학의 기초를 형성하고, 생명에 필수적이며, 다양한 산업에서 많은 응용을 보유하고 있습니다.