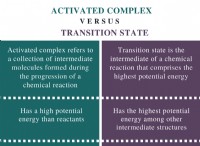
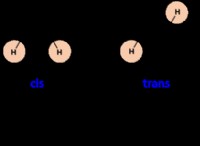
일부 물질이 가스로 존재할 수없는 이유 :
* 강한 분자간 힘 : 이 힘은 분자들 사이의 매력입니다. 매우 강한 분자간 힘 (이온 성 화합물 또는 일부 극성 공유 화합물)을 갖는 물질은 이러한 관광 명소를 극복하고 가스가되기 위해 많은 에너지가 필요합니다.
* 예 : 테이블 소금 (NaCl)은 강한 이온 결합을 가지므로 결정 구조를 분해하고 가스를 형성하기가 매우 어렵습니다.
* 높은 끓는점 : 끓는점은 액체가 가스로 변하는 온도입니다. 비등 지점이 높은 물질은 종종 분자간 힘이 강하며 정상 온도와 압력에서 가스로 존재하지 않을 것입니다.
* 예 : 설탕 (Sucrose)은 끓는점이 매우 높으며 기화되기 전에 분해됩니다.
액체와 기체 상태 모두에 일부 물질이 존재할 수있는 이유 :
* 약한 분자간 힘 : 이 물질들은 분자들 사이의 명소가 약해져 이러한 힘을 극복하고 기체 상태로 들어가기가 더 쉬워집니다.
* 예 : 물 (HATER)은 수소 결합을 가지며, 이온 결합만큼 강하지는 않지만 강하지는 않습니다. 실온에서 액체로 존재할 수 있지만 가열하면 기화 (가스가됩니다).
* 보통 비등점 : 중간 정도의 끓는점이있는 물질은 더 낮은 온도에서 액체와 고온에서의 가스로 존재할 수 있습니다.
* 예 : 에탄올 (c₂h (oh)은 적당한 끓는점을 가지며 액체와 가스 모두로 존재할 수 있습니다.
요약 :
가스로서 물질이 존재하는 능력은 분자 사이의 분자간 힘의 강도에 달려있다. 더 강한 힘은 기화하기가 더 어려워지고, 강한 힘을 가진 물질은 정상적인 조건에서는 기체 상태에 도달하지 못할 수 있습니다.