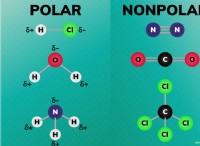
두 분자는 사면체 전자 형상을 갖는다.
* h₂o : 중심 산소 원자는 2 개의 고독한 쌍과 2 개의 결합 쌍의 전자를 갖는다. 이 전자 쌍은 서로를 격퇴하고 사면형 모양으로 자신을 배열합니다. 그러나 고독한 쌍의 존재로 인해 분자의 실제 모양은 구부러져 있습니다 (또는 V 자형).
* cf c : 중심 탄소 원자는 4 개의 결합 쌍의 전자를 가지며, 이는 사면체 형태로 배열된다. 고독한 쌍이 없기 때문에 분자 모양은 또한 사면체입니다.
그러나 분자 모양은 다릅니다.
* h₂o : 구부러진 또는 V 자형
* cf c : 사면체
이러한 형태의 차이는 물의 산소 원자에 고독한 쌍의 존재로 인해 발생하며, 이는 사면체 형상의 왜곡을 유발합니다.
다른 차이점 :
* 본딩 : H, CF₄는 극성 공유 결합 (산소와 수소 사이의 전기 음성 성 차이로 인해)을 가지며, CF₄는 극성 공유 결합 (탄소와 불소의 전기 음성 성 차이로 인해)을 가지지 만, 분자는 대칭성 세공성 형태로 인해 비극성이다.
* 극성 : h₂o는 구부러진 형상으로 인해 극성 분자이며 CF₄는 비극성 분자입니다.
* 용융 및 끓는점 : H, HATE는 CFA에 존재하지 않는 수소 결합으로 인해 CFA보다 용융 및 끓는점이 훨씬 높습니다.
따라서, 두 분자는 사면체 전자 형상을 공유하지만 분자 형상, 극성 및 결합의 차이는 매우 다른 특성을 초래한다.