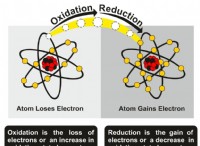
* 금속 및 비금속 : 이온 결합은 금속과 비금속 사이에 형성됩니다.
* 정전기 적합성 : 금속은 전자를 잃게하여 양으로 하전 된 이온 (양이온)이되는 반면, 비금속은 전자를 이득하여 음으로 하전 된 이온 (음이온)이됩니다. 이 반대의 혐의는 서로를 끌어 들이고 이온의 결합을 형성합니다.
몇 가지 예를 분석하겠습니다.
이온 성 화합물 :
* NaCl (염화나트륨) : 나트륨 (NA)은 금속이고 염소 (CL)는 비금속입니다.
* MGO (산화 마그네슘) : 마그네슘 (mg)은 금속이고 산소 (O)는 비금속입니다.
* KBR (칼륨 브로마이드) : 칼륨 (k)은 금속이고 브롬 (BR)은 비금속입니다.
* CaCl2 (염화 칼슘) : 칼슘 (CA)은 금속이고 염소 (CL)는 비금속입니다.
* li2o (산화 리튬) : 리튬 (Li)은 금속이고 산소 (O)는 비금속입니다.
공유 화합물 (이온 결합을 함유하지 않음) :
* CO2 (이산화탄소) : 탄소 (C) 및 산소 (O)는 비금속이다.
* H2O (물) : 수소 (H) 및 산소 (O)는 비금속입니다.
* CH4 (메탄) : 탄소 (C) 및 수소 (H)는 비금속이다.
중요한 참고 : 이온 성 및 공유 결합 특성을 모두 나타내는 일부 화합물이 있습니다. 이들은 다 원자 이온으로 알려져있다 종종 이온 성 화합물에서 개별 단위로 취급됩니다.
예를 들어, nh4cl (염화 암모늄) 다 원자 이온 NH4+ (암모늄)를 함유한다. 암모늄 이온은 질소와 수소 사이의 공유 결합에 의해 형성되는 반면, 이온 성 화합물에서 단일 양으로 하전 된 단위로서 음으로 하전 된 염화물 이온 (Cl-)에 끌린다.
확실히, 당신은 항상 주기율표를 참조하고 화합물과 관련된 요소를 식별하여 금속인지 비금속인지 확인할 수 있습니다.