* 특정 금속 : 다른 금속마다 특성이 다르며 액체에 용해 될 때 다르게 행동합니다.
* 액체의 특성 : 액체가 물, 산 또는 다른 용매인지 여부는 결과에 크게 영향을 미칩니다.
* 조건 : 온도 및 압력과 같은 요인은 프로세스에도 영향을 줄 수 있습니다.
금속 요소가 액체에 녹은 후 발생할 수있는 일에 대한 몇 가지 가능성은 다음과 같습니다.
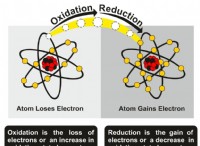
1. 이온의 형성 :
* 많은 경우에, 금속은 전자를 잃고 긍정적으로 하전 된 이온 (양이온)을 형성하여 액체에 용해됩니다. 이 과정을 산화 라고합니다 .
* 그런 다음 이들 이온은 용매 분자와 상호 작용하여 수화 된 이온의 형성으로 이어질 수 있습니다. .
예 : 나트륨 (NA) 금속은 물과 반응하여 나트륨 이온 (Na+) 및 수산화 이온 (OH-)을 형성하여 부산물로서 수소 가스를 생성한다.
2. 화합물 형성 :
용해 된 금속 이온은 액체의 다른 물질과 반응하여 새로운 화합물의 형성을 초래할 수 있습니다.
* 이것은 액체에 존재하는 음이온 또는 다른 용해 된 금속으로 발생할 수 있습니다.
예 : 철 (Fe)은 희석 된 염산 (HCl)과 반응하여 철 (II) 클로라이드 (FECL2) 및 수소 가스를 형성합니다.
3. 산화 환원 반응 :
* 금속 용해에는 산화 환원 반응이 포함될 수 있습니다 , 다른 물질이 감소하는 반면 (전자 손실) 금속이 산화되는 곳 (전자).
* 이것은 강산 또는 산화제의 존재 하에서 일반적입니다.
예 : 구리 (Cu)는 질산 (II) 질산염 (Cu (NO3) 2), 이산화 질소 (NO2) 가스 및 물을 형성하기 위해 질산 (HNO3)과 반응한다.
4. 반응 없음 :
* 일부 금속은 특정 액체에 불활성이며 전혀 녹지 않을 수 있습니다.
예를 들어, 금 (AU)은 대부분의 산과 반응하지 않습니다.
5. 복잡한 형성 :
* 일부 금속은 복잡한 이온을 형성 할 수 있습니다 용액에 존재하는 용매 분자 또는 다른 리간드로.
* 이들 복합체는 단순한 금속 이온과 다른 특성을 나타낼 수있다.
예 : 구리 (II) 이온 (Cu2+)은 암모니아 (NH3)와 복합체를 형성하여 테트라 암민 콥 (II) 이온 ([Cu (Cu (NH3) 4] 2+)를 형성 할 수있다.
특정 반응과 결과는 특정 금속, 액체 및 관련된 조건에 따라 다를 것입니다.