작동 방식은 다음과 같습니다.
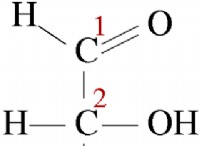
* CO2는 물에 용해됩니다 : CO2가 물에 용해되면 탄산산 (H2CO3)을 형성합니다.
* 탄산 산산화물 : 탄산은 중탄산염 이온 (HCO3-) 및 수소 이온 (H+)에 부분적으로 분리되는 약산이다.
* 버퍼링 동작 : 탄산산 (H2CO3)과 중탄산염 이온 (HCO3-)의 존재는 완충 시스템을 생성한다. 이 시스템은 첨가 된 산 (H+)과 염기 (OH-)를 모두 흡수하여 pH의 상당한 변화를 방지 할 수있다.
자연수에서 완충제 역할을 할 수있는 다른 물질은 다음과 같습니다.
* 중탄산염 이온 (HCO3-) 그 자체는 특히 알칼리 물에서 완충제 역할을 할 수 있습니다.
* 다른 약산과 그들의 컨쥬 게이트 염기 붕산 (H3BO3) 및 붕산염 이온 (BO33-)과 같은, 특정 수체의 완충 용량에 기여할 수 있습니다.
버퍼링의 중요성 :
버퍼링은 자연수의 화학적 안정성을 유지하는 데 중요합니다. 도움이됩니다.
* 수생 생물 보호 : 많은 수생 유기체는 PH 변동에 민감하므로 버퍼는 안정적인 환경을 유지하는 데 도움이됩니다.
* 과도한 산도 또는 알칼리성을 방지 : 버퍼링은 생태계에 유해 할 수있는 pH의 극적인 변화를 방지합니다.
참고 : 자연수의 버퍼링 용량은 다음과 같은 요인에 따라 다릅니다.
* CO2의 농도 : CO2 수준이 높을수록 일반적으로 버퍼링 용량이 증가합니다.
* 알칼리성 : 알칼리성이 높은 물 (기초의 총 농도)은 더 큰 버퍼 용량을 갖습니다.
이러한 측면에 대한 자세한 내용을 원하시면 알려주세요!