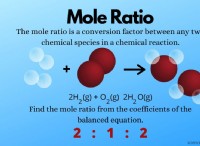
pH 및 [H+] 이해
* pH : 용액의 산도 또는 알칼리도 측정. 그것은 용액에서 수소 이온 ([H+])의 농도에 기초합니다.
* [H+] : 리터당 몰 (mol/L)으로 발현 된 수소 이온의 농도.
관계
pH와 [H+]의 관계는 다음 방정식으로 정의됩니다.
pH =-log [h+]
[h+]를 찾으려면 방정식을 재정렬해야합니다.
[h+] =10^(-ph)
계산 :
1. pH 값을 대체하십시오 : [H+] =10^(-12.83)
2. 계산 : [h+] ≈ 1.48 x 10^(-13) mol/l
따라서, 12.83의 pH를 갖는 용액의 수소 이온 농도 ([H+])는 약 1.48 x 10^(-13) mol/l. 이다.
중요한 참고 : 12.83의 pH는 매우 기본적인 (알칼리성) 용액을 나타냅니다.