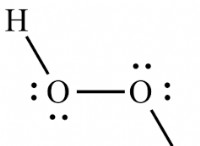
c (s) + o₂ (g) ⇌ co₂ (g)
제공 한 반응이 잘못된 이유와 평형 상수에 접근하는 방법은 다음과 같습니다.
반응이 잘못된 이유 :
* 불완전한 연소 : 당신이 제공 한 반응은 일산화탄소 (CO) 만 생성합니다. 산소의 존재 하에서 탄소의 완전한 연소는 이산화탄소 (CO₂)를 생성한다.
정확한 반응 :
c (s) + o₂ (g) ⇌ co₂ (g)
평형 상수 (k) :
이 반응에 대한 평형 상수 (k)는 다음과 같이 표현된다.
k =[Co k] / [c] [o₂]
* [Co [] 평형에서 이산화탄소의 농도입니다
* [C] 고체 탄소의 농도입니다 (이 경우 일정하게 간주됩니다)
* [o [] 평형에서 산소 가스의 농도입니다
중요한 메모 :
* 고체 상 : 탄소 (C)는 고체이므로, 농도는 일정하게 간주되며 평형 발현에는 포함되지 않습니다.
* 표준 조건 : 평형 상수는 일반적으로 표준 조건 (298k 및 1 atm)에서 제공됩니다.
* 큰 k 값 : 이 반응의 평형 상수는 매우 크며, 이산화탄소의 형성이 매우 유리하다는 것을 나타냅니다.
계산 k :
K의 실제 값을 계산하려면 이산화탄소 및 산소 가스의 평형 농도를 결정해야합니다. 이것은 실험적으로 또는 열역학적 데이터를 사용하여 수행 할 수 있습니다.
이 점들 중 하나에 대해 자세히 설명하고 싶다면 알려주세요!