화학적 공식 H2O2와 함께, 과산화수소는 물보다 점점이 다소 점점이 더 큽니다. 빛이있을 때는 불안정하고 분해 가능합니다. 인체에도있을 수 있습니다.
H2O2 중요성의 Lewis 구조는 분자 지오메트리/모양, 결합 각도, 하이브리드 화 및 기타 주제가 논의 될 것임을 나타냅니다. H2O2 비극성 또는 극성 등입니다.
H2O2는 순수 할 때 쓴 맛이있는 무색 액체입니다. 하나의 산소 산소 링크 만있는 가장 기본적인 과산화물입니다. 끓는 온도로 가열되면 H2O2는 극도로 위험 해져 폭발하여 심한 화상을 유발합니다.
H2O2 의미와 중요성의 구조를 살펴 보겠습니다! .
과산화수소의 유용한 특성
• 그것은 강력한 산화제입니다.
• 신맛이 있습니다.
• H2O2
• 섭씨 0.43도이고 끓는점은 섭씨 150.2도입니다.
• Petroleum Ether에서는 불용성입니다.
과산화수소의 사용
• 피부의 상처 나 화상으로 인한 감염을 방지하는 데 사용됩니다.
• 의료 장비를 소독하는 동안 편리합니다.
• 냉장고를 음식으로 청소하고 복원하려면
• 과일과 채소에서 먼지를 제거합니다.
• 소독제 역할을합니다.
h2o2의 Lewis 구조를 스케치하는 가장 좋은 방법은 무엇입니까?
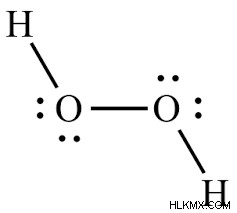
2 개의 산소와 2 개의 수소 원자가 H2O2의 Lewis 구조에서 2 개의 O-H 결합과 1 개의 O-O 링크를 만듭니다. H2O2 의미의 루이스 구조에는 4 개의 고독한 쌍과 3 개의 결합 쌍이 있습니다.
h2o2 중요의 Lewis dot 구조는 상당히 간단하며 스케치하는 것은 다른 분자를 그리는 것과 유사합니다. 이 단계별로 어떻게 만드는 방법을 살펴 보겠습니다.
h2o2 를 그리는 몇 가지 단계를 따르십시오. 루이스 도트 구조
H2O2의 총 원자가 전자 수를 결정합니다.
첫 번째 단계는 그 안에 얼마나 많은 원자가 전자가 있는지 알아내는 것입니다. 따라서 수소와 산소 주기적 그룹을 살펴 보겠습니다.
수소는 원자가 쉘에 전자 하나만 있고 산소는 주기적 테이블의 16 번째 그룹에 속하기 때문에 원자가 쉘은 6 개의 전자를 가지고 있습니다.
산소 원자가 전자는 6
입니다수소 원자가 전자 =1
H2O2 =12 + 2*6 =14
의 루이스 구조를 그릴 수있는 총 원자가 전자 수중앙에 가장 적은 전기 음성 원자를 배치하십시오.
분자에 수소가있을 때 어떤 원자가 어느 정도 전기 음성이든 상관 없습니다. 수소는 항상 분자 외부에서 루이스 구조를 형성하며 원자가 쉘을 완성하기 위해 두 개의 전자 만 필요합니다.
수소와 산소 사이의 단일 연결을 만듭니다.
수소와 산소를 삽입 한 후 H2O2의 구조를 더 끌어들일 수 있도록 단일 결합과 결합해야합니다.
외부 원자부터 시작하여 나머지 원자가 전자를 놓습니다.
이제 외부 원자부터 시작하여 나머지 원자가 전자를 위에서 언급 한 구성에 배치해야합니다.
그러나 H2O2의 루이스 구조의 외부 원자는 수소이며, 수소는 원자가 쉘을 완성하기 위해 두 개의 전자 만 필요합니다.
H2O2 구조에서 수소는 이미 산소 원자와의 단일 결합을 사용하여 두 개의 전자를 공유합니다.
결과적으로 나머지 원자가 전자는 산소 주위에 배열되어 옥트 규칙을 완성했습니다.
코어 원자 옥트를 완성하고 필요한 경우 공유 링크를 형성합니다.
이것은 H2O2의 Lewis 구조를 그리는 마지막 단계입니다. 이 단계에서 나머지 원자가 전자를 산소 원자 주위에 놓으려면 옥트 규칙을 완료하십시오.
우리는 8 개의 원자가 전자가 남아 있고 산소는 외부 껍질을 완성하기 위해 8 개의 전자가 필요합니다. 또한 단일 결합의 도움으로 각 산소는 이미 4 개의 전자를 공유합니다.
결과적으로, 각 산소는 4 개의 원자가 전자 만 필요합니다. 결과적으로 남은 원자가 전자는 산소 원자에 배치해야합니다.
H2O2의 분자 형상 및 하이브리드 화는 무엇입니까?
과산화수소의 분자 구조 (H2O2)는 비 플래르 분자이며 심지어 공개 서적 구조를 가지고 있다고합니다.
.VSEPR 이론에 따르면, 산소 원자의 고독한 쌍 전자는 반발을 줄이기 위해 가능한 한 다른 원자의 전자 구름에 반대 할 것이다. 결과적으로, 무한한 전자 커플은 인접한 결합 쌍을 밀어냅니다.
는 과산화수소입니다 ( h2o2 ) 극 또는 비극성
많은 사람들이 H2O2가 극지인지 비극적인지 확실하지 않습니다. H2O2는 분자 기하학이 구부러지고 코어 원자 (산소)에 고독한 쌍의 존재는 불평등 한 전하 분포를 초래하기 때문에 극성 분자입니다.
결론
많은 강도의 솔루션으로 생성 된 무색 액체 인 H2O2는 주로 면화 및 기타 직물, 목재 펄프, 다른 화학 물질의 합성, 로켓 연료, 화장 및 치료 용도에 주로 사용됩니다. 그러나 8% 이상의 과산화수소를 함유하는 용액은 피부에 부식성입니다.