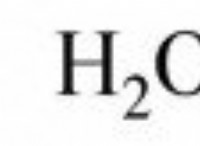* 용해도 및 온도 : 일반적으로, 대부분의 이온 성 화합물의 용해도는 온도가 증가함에 따라 증가합니다. 이는 더 높은 온도가 이온 결합의 파괴에 더 많은 에너지를 제공하여 이온이 분리되고 용해 될 수 있기 때문입니다.
* 클로라이드의 행동을 이끌어냅니다 : 염화 납은 이러한 일반적인 추세를 나타내지 만, 온수에서도 용해도는 여전히 매우 낮습니다. 상대적으로 낮은 용해도의 이유는 납 (PB²)와 클로라이드 (Cl⁻) 이온 사이의 강한 이온 성치에 있습니다. 이 강력한 매력은 이온이 뜨거운 물에서도 분리하고 녹기가 어렵습니다.
* 다른 용매에서의 용해도 : 염화 납은 또한 복잡한 이온의 형성으로 인해 농축 염산 (HCL)과 같은 고농도의 염화물 이온을 함유하는 용액에 용해됩니다.
따라서 따라서 염화물을 납한다는 진술은 뜨거운 물에만 용해됩니다. 그것은 뜨거운 물과 냉수 모두에 드물게 용해되며 온도에 따라 용해도가 증가합니다.