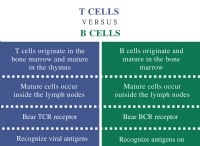
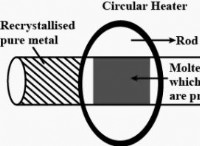
고장은 다음과 같습니다.
* stp (표준 온도 및 압력) : 0 ° C (273.15 K) 및 1 atm 압력.
* 몰 질량 : 물질 1 몰의 질량 (두더지 당 그램, g/mol).
* 밀도 : 단위 부피당 질량 (리터당 그램, G/L).
관계는 다음과 같습니다.
STP에서 가스의 몰 질량은 리터당 그램의 가스의 밀도와 수치 적으로 동일하다. .
이유는 다음과 같습니다.
* 이상적인 가스 법칙 : pv =nrt, 여기서 p는 압력, v는 부피, n은 두더지, r은 이상적인 가스 상수, t는 온도입니다.
* stp : 이상적인 가스의 1 몰의 부피는 22.4 L입니다.
* 이상적인 가스 법칙 재배치 : 밀도 (ρ) =(질량 / 부피) =(N * Molar Mass) / V.
* 치환 : STP에서 n =1 몰 및 V =22.4 L이므로 밀도는 몰 질량 / 22.4 L이됩니다.
따라서, 몰 질량은 수치 적으로 stp에서 g/l의 밀도와 같습니다.
중요한 참고 : 이 관계는 STP의 이상적인 가스에 대해서만 적용됩니다. 실제 가스는 이상적인 행동에서 벗어나고 밀도는 계산 된 값과 약간 다를 수 있습니다.