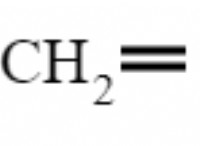이유는 다음과 같습니다.
* 분자 형상 : H₂S는 구부러진 또는 V 자형 분자 형상을 가지고 있습니다. 중심 황 원자는 2 개의 결합 쌍 (수소 원자)과 2 개의 고독한 쌍의 전자 쌍을 가지기 때문입니다.
* VSEPR 이론 : VSEPR (ralence Shell Electron Pair Relicult) 이론은 중심 원자 주위의 전자 쌍이 반발을 최소화하기 위해 스스로 배열 될 것이라고 예측합니다. 고독한 쌍은 결합 쌍보다 반발력이 더 강합니다.
* 본드 각도 편차 : 2 개의 결합 쌍과 2 개의 고독한 쌍이있는 분자의 이상적인 결합 각도는 109.5도 (사면체)입니다. 그러나 황의 고독한 쌍은 결합 쌍을 함께 밀어 넣어 결합 각도가 109.5도보다 약간 작습니다.
요약 : 황 원자의 고독한 쌍은 결합 각도에 유의하게 영향을 미쳐 이상적인 사면체 각도보다 적고 92도에 가깝습니다.