* 평형 화살표의 존재 (⇌) : 약산 및 염기는 용액에서 완전히 이온화되지 않습니다. 그것들은 이중 화살표로 표시되는 접합체 염기/산과 평형으로 존재합니다. 반면에 강한 산 및 염기는 완전한 이온화를 나타내는 단일 전방 화살표 (→)로 묘사됩니다.
예 :
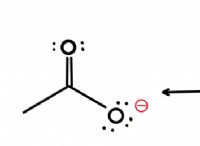
* 약산 : ch₃cooh h h⁺ + ch₃coo⁻ (아세트산)
* 강산 : HCL → H⁺ + CL⁻ (염산)
* 기호 :
* ha (약산의 일반적인 공식)
* b (약한 기지를위한 일반 공식)
* pka/pkb 값 : 약산 및 염기는 일반적으로 -2 내지 12의 범위 인 PKA/PKB 값을 갖는다. 강산 및 염기는 각각 훨씬 낮거나 높은 PKA/PKB 값을 갖는다.
* 설명 : 방정식과 함께 제공되는 텍스트에서 "약산"또는 "약한베이스"와 같은 설명을 찾을 수 있습니다.
중요한 참고 : 이것들은 좋은 지표이지만, 산 또는 염기의 강도를 확인하기 위해 교과서 나 화학 데이터베이스와 같은 신뢰할 수있는 소스를 참조하는 것이 가장 좋습니다.