이유는 다음과 같습니다.
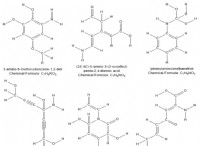
* 화합물의 정의 : 화합물은 둘 이상의 다른 원소가 고정 비율로 화학적으로 결합 될 때 형성된 물질이다.
* 화학 결합 : 화합물에서 원자들 사이의 화학적 결합은 원소의 특정 비율을 결정한다. 이러한 결합은 전자의 공유 또는 전달에 의해 형성되어 안정적인 배열이 생성된다.
* 명확한 비율의 법칙 : 이 법률은 주어진 화학 화합물이 공급원 또는 준비 방법에 관계없이 질량별로 동일한 요소를 항상 함유한다고 명시하고 있습니다.
예 :
* 물 (HATE)에는 강, 빙하 또는 실험실이든 상관없이 항상 두 개의 수소 원자와 하나의 산소 원자가 포함됩니다.
예외 :
일반적인 규칙은 사실이지만이 원칙에는 몇 가지 예외가 있습니다.
* 동위 원소 : 요소는 다른 동위 원소를 가질 수 있습니다 (양성자 수는 동일한 수의 양성자이지만 다른 수의 중성자). 이것은 화합물 내의 원소의 질량 비율의 변화를 초래할 수있다.
* 동반자 : 일부 요소는 Allotropes (예를 들어, 다이아몬드, 흑연 및 Fullerene)라고하는 다른 형태로 존재할 수 있습니다. 이것은 화학 성분을 바꾸지 않지만 화합물의 물리적 특성에 영향을 줄 수 있습니다.
그러나 이러한 예외를 제외하고 기본 원리는 유효합니다. 화합물은 고정되고 예측 가능한 조성물을 갖습니다.