핵심 개념
이 기사에서 우리는“불포화의 정도”를 면밀히 살펴보고, 그것들이 무엇인지, 계산하는 방법, 개념을 가진 중요한 경고를 포함하여.
.불포화 정도는 무엇입니까?
"수소 결핍 지수"라고도하는 "불포화 정도"는 화학자들이 알려지지 않은 화합물을 식별하려고 할 때 사용하는 중요한 도구입니다. 유기 화학에서, 원시 분자식은 화합물의 구조에 대한 많은 정보를 제공하지 않습니다. 예를 들어, 우리는 공식 C 7 에 맞는 다수의 구조를 상상할 수 있습니다. H 9 o 3 n.
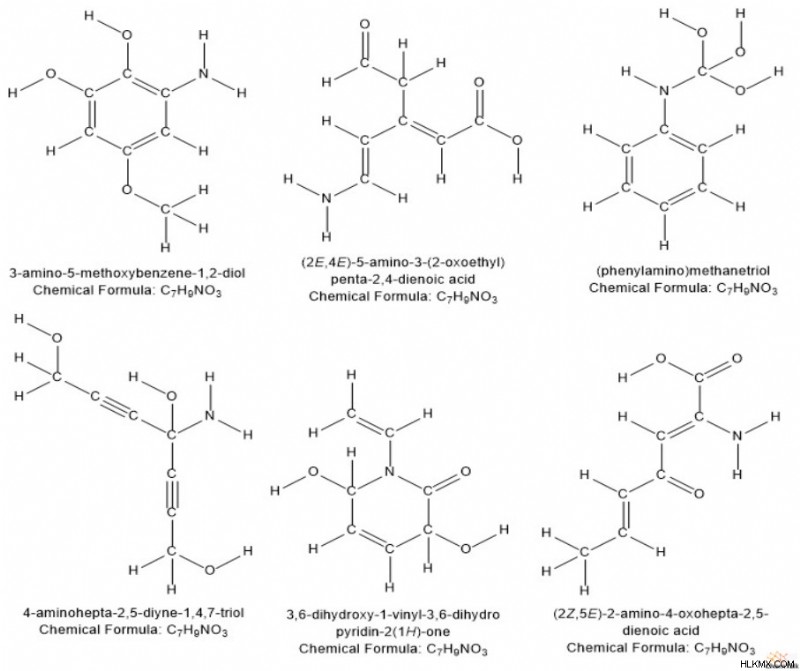
그러나 화학자들은 공식을 살펴보면 화합물의 "불포화 정도"를 계산할 수 있으며, 이는 약간 더 통찰력을 제공합니다. 간단히 말해서, 구조물의 불포화 정도는 PI 결합 및 링 구조의 총 합입니다.
중요하게도, "불포화"는 용매 용성 의미에서 포화를 나타내는 것이 아니라, 탄소가 수소와 함께 "포화"되는 정도입니다. 생화학에서 포화 지방산은 불포화 지방산보다 더 많은 수소가 있음을 기억할 수 있습니다.
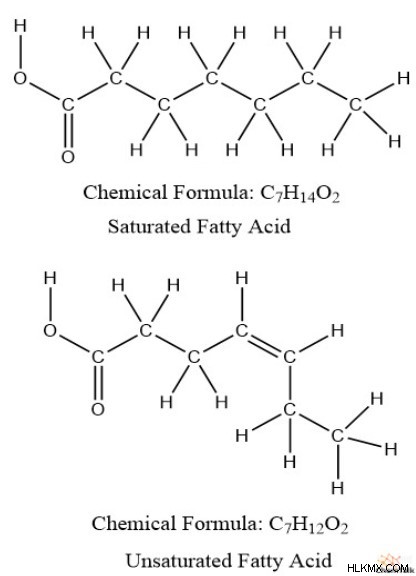
또한, 불포화 지방산은 포화 지방산보다 이중 결합 형태로 더 많은 PI 결합을 갖는다. 이것으로부터, 우리는 PI 결합과 수소 사이에 역 관계가 존재한다는 것을 알 수있다. 또한, 고리 구조는 비 사이 클릭 구조보다 적은 수소를 갖는 경향이있다; 예를 들어, 헥산 (c 6 를 가져갑니다 h 14 ) 대 사이클로 헥산 (c 6 H 12 ).
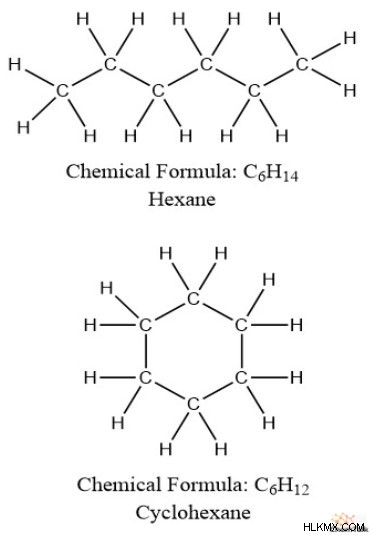
수소, PI 결합 및 링 사이의 이러한 관계는 모두 불포화 정도를 계산하는 방법에 영향을 미칩니다.
불포화 정도를 계산하는 방법
헤테로 원자가없는 탄화수소의 경우 다음 공식을 사용하여 불포화 정도를 계산할 수 있습니다.
dou =(2c + 2 - h)/2
c =공식의 탄소 수
h =공식에서의 수소 수
앞에서 언급 한 바와 같이, 총 불포화 정도는 구조의 결합 된 PI 결합과 고리를 나타냅니다. 이 공식은 탄화수소의 최대 수소 수가 탄수화 수와 2의 수의 두 배라는 사실에서 비롯됩니다. 우리는 완전히 포화 된 화합물 프로판, 헥산 및 도데칸 에서이 현상을 볼 수 있습니다.
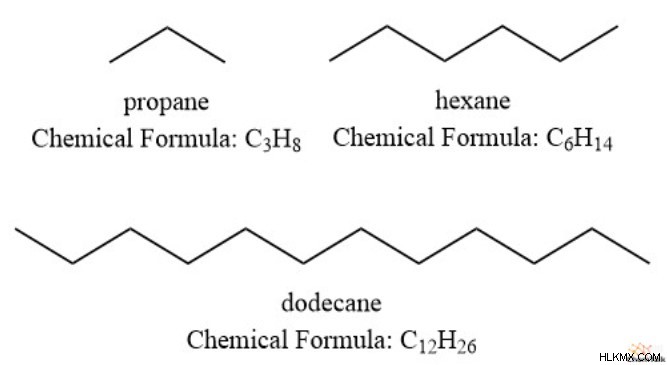
탄화수소에 수소가 적은 경우 이어야합니다 PI 본드 또는 링 구조가 있습니다. 이것은 공식의 가능한 구조를 몇 가지 그럴듯한 옵션으로 제한하기 때문에 엄청나게 유용합니다.
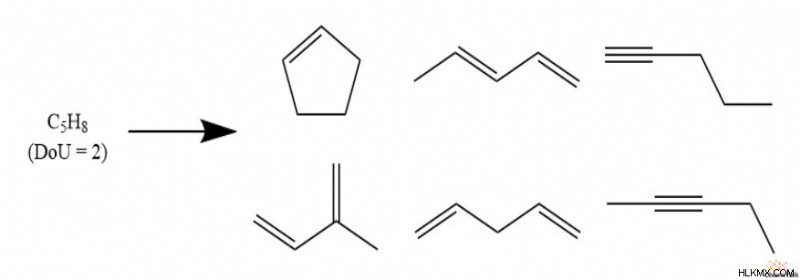
그러나, 화합물의 불포화 정도가 0이되어 완전히 포화 되더라도, 공식이 나타날 수있는 여러 구조가 여전히 남아있다. 예를 들어, C 6 h 14 대부분은 종종 헥산을 나타내지 만 3- 메틸 펜타 인은 동일한 공식을 가지고 있습니다.
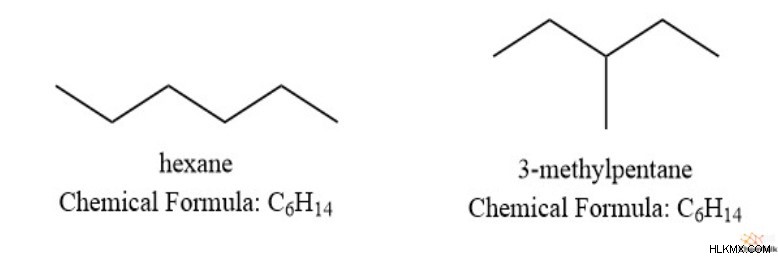
또한, 유용한 팁으로서, 비교적 작은 구조 (10 개의 탄소 미만)가 불포화 수가 4 이상인 경우 페닐기가있을 가능성이 높습니다. 이러한 경우에 대체 구조가 존재하지만 방향족 분자와 동일한 구조적 안정성과 단순성이 없을 것입니다.
불포화 정도는 탄화수소에 유용한 것처럼 보이지만, 우리가 알려지지 않은 산소, 질소 등이있을 때 무엇을 말해 주나요?
이종 원자를 사용한 불포화 정도
불포화에 대한 헤테로토 탄 (비 탄소 또는 하이드로겐)의 효과를 평가할 때, 우리는 스스로에게 중요한 질문을해야합니다.
할로겐
시작하려면 할로겐을 살펴 보겠습니다. 염소 나 브롬이 구조에 존재하면 본질적으로 수소를 대체합니다.
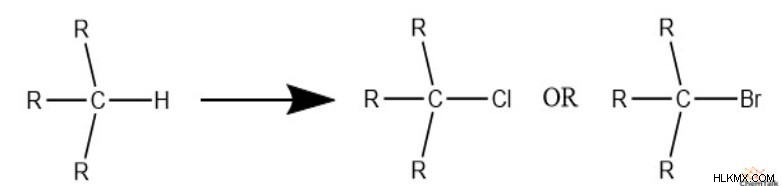
예를 들어, 2 개의 탄소와 1 개의 염소가있는 구조의 경우, 구조는 최대 5 개의 수소 수를 가질 수 있습니다. 그러나, 구조에는 PI 결합 또는 고리가 없으므로 여전히 포화되어야하며 불포화의 0이 0입니다.
따라서, 불포화 정도를 계산할 때, 우리는 수소 총에 할로겐의 수를 추가해야합니다. 화합물의 각 할로겐이 수소가 차지할 수있는 위치를 나타냅니다.
질소
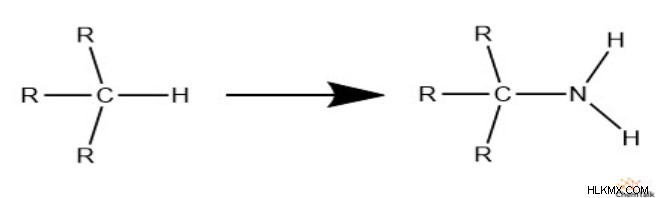
다음으로 질소를 고려해 봅시다. 질소가 수소가 차지할 수있는 공간을 차지하면 수소를위한 두 개의 추가 공간을 제공합니다.

그것은 수소가 결합하기위한 한 지점의 순이익입니다. 따라서 구조가 완전히 포화 되려면 질소 당 추가 수소가 있어야합니다. 따라서 불포화를 계산할 때 수소에서 니트로겐의 수를 빼야합니다.
산소 및 황
마지막으로 산소와 황을 살펴 보겠습니다. 수소를 대체 할 때 수소가 결합 할 공간이 하나 있습니다.
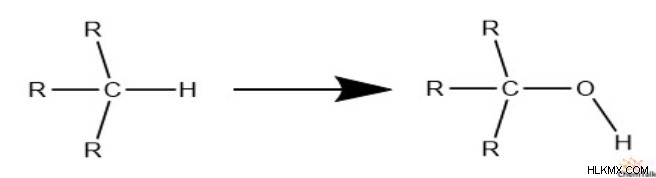
그것은 산소와 황의 존재가 불포화에 순간에 영향을 미친다는 것을 의미합니다. 우리는 이것을 에탄올과 에탄에 티올에서 볼 수 있으며, 둘 다 완전히 포화 된 구조를 가지고 있습니다.
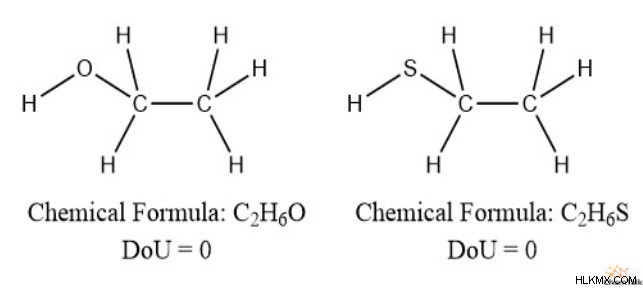
따라서 불포화 정도를 계산할 때 산소와 황을 완전히 제거 할 수 있습니다.
디럭스 도의 불포화 정도
이종 원자에 대한 우리가 알고있는 것을 통합하여 다음 공식을 사용하여 Heterocompounds의 불포화를 계산할 수 있습니다.
불포화 정도 =(2c + 2 - (h + x - n))/2
c =공식의 탄소 수
h =공식에서의 수소 수
x =공식
의 할로겐 수n =공식에서의 니트로겐 수
참고 :알려지지 않은 화합물이 전이 금속과 같이 우리가 말한 것과 다른 헤테로로 톰을 가지고 있다면, 산화 상태가 다양한 산화 상태를 가지고 있기 때문에 불포화 정도에 예측할 수없는 영향을 미칩니다. 그러나 위의 공식은 유기 화학 과정에서 발생하는 대다수의 화합물에 적용됩니다.
앞에서 언급했듯이 불포화 정도를 계산하면 옵션이 좁아 지지만 주어진 공식에 대한 여러 가지 가능한 화합물이 여전히 남아 있습니다. 따라서 불포화 정도는 질량 사양, IR 및 NMR 기술과 함께 사용되며, 이는 퍼즐에 자체 조각을 제공합니다. 각각의 분석 기술을 사용하면 종종 유기 화합물의 정확한 구조를 도출 할 수 있습니다. 이것을 실제로 보려면 구조 분석 에서이 기사를 확인하십시오.