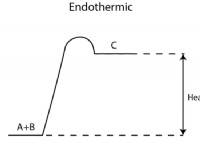
* 산화 상태 : 산성 용액에서, mno₄⁻ (과망간산염 이온)은 mn² (망간 (II) 이온)으로 감소된다. 이는 산화 상태가 +7 내지 +2로 5 개의 전자의 이득을 나타내는 것을 나타냅니다. 알칼리성 용액에서, mno₄⁻는 Mno₂ (이산화 망간)으로 감소되며, 이는 3 개의 전자의 이득 인 +7 내지 +4 로의 산화 상태의 변화이다.
* 전기 화학 전위 : 산성 반응 (MNO₄⁻ + 8H⁺ + 5E⁻ → Mn²⁺ + 4H₂O)에 대한 표준 감소 가능성은 +1.51V 인 반면, 알칼리 반응 (MNO₄⁻ + 2H₂O + 3E⁻ → MNO₂ + 4OH⁻ → MNO₂ + 4OH⁻)에 대한 전위는 +0.59 V입니다. 더 높은 양의 감소 전위는 더 강한 산화제를 나타냅니다.
요약 :
* 산성화 된 칼륨 망간은 산화 상태를 더 크게 감소시켜 더 큰 전자 이득을 초래합니다.
* 이로 인해 긍정적 인 감소 전위가 높아져 산화력이 더 강해집니다.
실질적인 영향 :
* 산성화 된 칼륨 망간은 일반적으로 다양한 반응에서 강한 산화제로 사용됩니다.
* 알코올의 알데히드 및 케톤으로의 산화
* 알켄의 산화
* 분석 화학에서 유기 화합물을 분해합니다
* Alkali Manganate는 산화력이 약하고 다음과 같은 특정 반응에 사용됩니다.
* 알칼리성 조건에서 유기 화합물의 산화
* 침전물로서 이산화 망환 (mno₂)의 형성