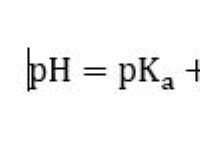정의 :
* 공유 본드 : 원자 사이의 전자 쌍의 공유에 의해 형성된 결합.
* 트리플 본드 : 3 쌍의 공유 전자를 포함하는 공유 결합.
특성 :
* 강한 채권 : 트리플 결합은 일반적으로 두 원자 사이의 전자 밀도가 더 높기 때문에 일반적으로 단일 또는 이중 결합보다 강합니다. 이것은 결합 길이가 짧고 결합 분리 에너지가 더 높아집니다.
* 선형 형상 : 트리플 결합에 의해 연결된 원자는 전형적으로 결합 원자와 인접한 원자가 직선에 놓여있는 선형 모양을 형성한다.
* 높은 결합 에너지 : 트리플 본드는 결합 에너지가 높기 때문에이를 파괴하려면 상당한 양의 에너지가 필요합니다.
* 제한된 회전 : 단일 결합과 달리, 트리플 결합은 단단한 전자 분포와 원자들 사이의 강한 인력으로 인해 제한된 회전을 나타낸다.
예 :
* 질소 가스 (N2) : 각각의 질소 원자는 3 개의 전자를 다른 전자와 공유하여 트리플 결합 (N≡N)을 형성한다.
* 아세틸렌 (C2H2) : 아세틸렌의 2 개의 탄소 원자는 트리플 결합 (C≡C)에 의해 연결된다.
* 시안화물 이온 (CN-) : 탄소 및 질소 원자는 트리플 결합 (C≡N)으로 연결됩니다.
키 테이크 아웃 :
* 트리플 본드는 3 개의 전자 쌍이 공유되는 특정 유형의 공유 결합입니다.
* 그들은 강하고 안정적이며 결합 에너지가 높습니다.
* 일반적으로 선형 기하학을 초래합니다.
시각적 표현 :
단일 결합을 나타내는 두 원자 사이에 그려진 선이 상상해보십시오. 이제 첫 번째 평행선 옆에 두 개의 평행 선을 더 그립니다. 이 3 라인 표현은 트리플 본드를 묘사하는 일반적인 방법입니다.