관계 이해
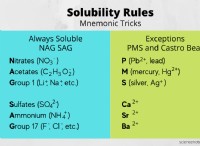
* 물 자동 이온화 : 물 분자는 자연적으로 소량으로 이온화되어 수소 이온 (H+) 및 수산화 이온 (OH-)을 생성합니다.
h₂o ⁺ h⇌ + ah⁻
* kw 상수 : 임의의 수용액에서 H⁺ 및 OH태의 농도의 생성물은 항상 물에 대한 ION 생성물 (KW)으로 알려진 일정한 일정이다.
kw =[h⁺] [OH⁻] =1.0 x 10 ¹⁴ 25 ° C에서
계산
1. OH⁻의 농도를 찾으십시오 :
* 우리는 [h⁺] =2.7 m을 알고 있습니다
* KW 방정식 사용 :[OH⁻] =kW / [HAT]
* [OHAT] =(1.0 x 10 ¹⁴) / (2.7) ≈ 3.7 x 10 ¹⁵ m
결론
2.7m HCl 용액에서 OH 이온의 농도는 대략 3.7 x 10 ¹⁵ m 입니다. . 이것은 HCL 용액의 매우 산성 특성을 반영하는 매우 낮은 농도입니다.