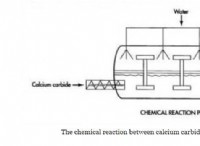
분자간 힘이란 무엇입니까?
분자간 힘은 영구적으로 또는 일시적으로 (일시적으로) 하전 된 화학 종 사이의 정전기 상호 작용입니다. 여기에는 반 데르 발스 세력 (상호 작용), 이온 다이폴 및 쌍극자 쌍극자 힘이 포함됩니다.
이 용어는 일반적으로 매력적인 상호 작용만을 언급하는 데 사용되며, 이는 분자와 이온을 응축 된 단계 (액체 및 고체)로 함께 유지합니다. 이 힘은 용융점, 끓는점 및 표면 장력과 같은 물질과 혼합물의 많은 물리적 특성을 지배합니다.
관련 주제
- 양이온 및 음이온
- 이온 성 대 공유 결합
- 쌍극자 순간은 무엇입니까?
- 공동 특성
- 균질 대 이종 혼합물
이온 결합 기본
이온 결합으로도 알려진 이온-이온 력은 가장 간단한 것을 이해하기에 가장 간단합니다. 이 힘은 반대 전하가있는 두 이온 사이의 정전기 인력으로 인해 발생합니다. 그것들은 기술적으로 분자간 힘으로 간주되지 않습니다 , 그러나 실제 IMF (분자간 힘)를 이해하는 데 유용한 출발점입니다. 이온의 결합은 일반적으로 아래에 논의 된 힘보다 일반적으로 더 강하기 때문에 대부분의 순수한 소금은 매우 높은 온도를 제외하고 고체입니다.
이것의 완벽한 예는 섭씨 800 도인 NaCl의 테이블 소금입니다.
분자간 힘의 유형
반 데르 발스 세력
van der waals forces, 일명 Van der Waals 상호 작용, 가장 약한 분자간 힘이며 약한 쌍극자 쌍극자 힘과 더 강한 런던 분산 힘으로 구성됩니다. 그들은 네덜란드 화학자 Johannes van der Waals (1837-1923)의 이름입니다. 비 이상 가스의 반 데르 발스 방정식은 이러한 분자간 힘을 고려합니다. 이 힘은 물질이 주어진 온도에서 고체, 액체 또는 가스인지 여부를 결정합니다.
우리가 아래에서 논의 할 두 가지 유형의 반 데르 발스 세력이 있습니다-런던 분산 세력과 쌍극자 쌍극자 (상호 작용)
이온-쌍극자 힘
이온 다이폴 력은 전하 종과 극성 분자의 상호 작용으로 인해 발생합니다. 그것들은 이온 결합과 매우 유사하지만 극성 분자는 단지 부분적으로 만 가지고 있기 때문에 약한 경향이 있습니다. 정전기 인력을 덜 생성하는 전하. 이러한 힘으로 인해 극성 용매는 비극성 용매와 비교하여 NaCl과 같은 이온 성 고체를 더 잘 용해시킬 수 있습니다.
이온 유발 쌍극자 상호 작용
이온 다이폴 힘과 밀접한 관련이있는 것은 이온 유발 쌍극자 힘이다. 이 경우 분자에는 영구 쌍극자가 없습니다. 대신, 이온은 전자를 유치하거나 반발하여 비극성 분자로부터 과도 쌍극자를 생성합니다. 그런 다음 매력은 이온과 일시적 부분 전하 사이에 형성됩니다.
쌍극자 쌍극자 힘
쌍극자 쌍극자 힘은 van der waals force의 유형 입니다. . 두 개의 극성 분자가 상호 작용할 때, 반대 부분 전하는 이온 결합과 유사하게 유치하지만 일반적으로 더 작은 전하 크기로 인해 약합니다. 이러한 쌍극자 쌍극자 힘으로 인해 극성 화합물은 비극성 화합물보다 더 높은 용융 및 끓는점을 갖는 경향이 있습니다.
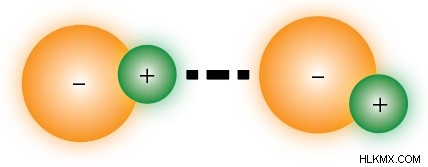
수소 결합
수소 결합은 특수한 유형의 쌍극자 쌍극자 상호 작용입니다. 문제의 분자가 수소 원자에 직접 결합되어 전기 음성 원자가 고도로 전기 음성 원자를 가질 때 발생하여 비정상적으로 극한의 쌍극자가 발생할 수 있습니다. 대부분의 목적을 위해,이 고도로 전기 음성 원자는 질소, 산소 및 불소로 제한됩니다.
수소 결합은 "공여자"분자와 "수용체"분자를 포함한다. 공여자는 결합에 대한 수소 원자를 제공하는 반면, 수용체는 전기 음성 원자를 제공한다. 아래 이미지에서, 상위 2 개의 물 분자는 모두 공여자 역할을하는 반면, 바닥 분자는 수용체로서 작용하고있다. 일부 분자는 수용자로만 작용할 수 있습니다.
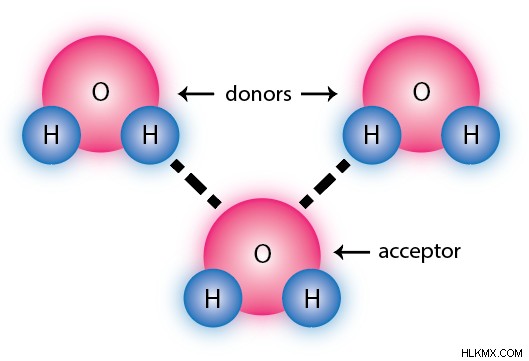
수소 결합은 또한 방향성입니다-결합은 3 개의 참여 원자가 대략 직선 (180도 각도) 인 경우 수소 결합으로 만 자격이 될 수 있습니다. 이것은 방향성이없는 일반 쌍극자 쌍극자 결합과 더 차별화됩니다.
런던 분산 세력 (LDF)
LDF로 종종 약칭되는 런던 분산 세력은 두 개의 일시적 쌍극자 사이의 매력입니다 . 그들은 또한 van der waals force의 유형입니다 . 이것은 직관적이지 않은 것처럼 보일 수 있지만 두 개의 비극성 분자가 서로 가까이있을 때 전자 구름의 진동으로 인해 둘 다 극성을 얻을 수 있습니다. 우리는 런던 분산 세력으로 일시적 하전 사이의 결과적으로 매력을 나타냅니다.
개별적으로 LDF는 일반적으로 분자간 힘 중 가장 약한 것입니다. 그러나 많은 LDF 상호 작용의 누적 효과는 전반적인 매력이 상당히 높을 수 있습니다. 상호 작용의 수는 분자의 표면 접촉 영역과 밀접한 관련이 있으므로, 큰 비극성 분자는 LDF로부터 상당히 많은 양의 인력을 경험할 수 있지만 작고 작고 소형은 거의 경험하지 못할 수 있습니다. 유사한 형태의 두 분자 (예 :2 개의 고귀한 가스)를 비교할 때, 어금니 질량이 더 높은 것은 LDF가 더 강해집니다.
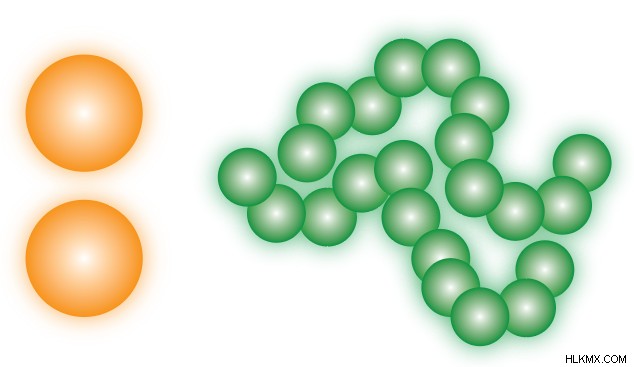
런던 분산 력은 비극성 분자에 존재하는 유일한 IMF이지만 다른 모든 유형의 물질에도 존재한다는 점에 유의해야합니다. . 극성 분자는 LDF에도 참여하지만,이 경우 다른 IMF보다 덜 중요하기 때문에 언급되지 않습니다.
.분자간 력 :가장 약한 것보다 가장 강한
- 이온 성 (기술적으로 IMF가 아님)
- 이온 다이폴
- 수소
- 쌍극자 쌍이폴
- 런던 분산군 (Van der Waals Force)
예 :IMF 강도 순위
1. 다음 혼합물을 가장 강한 IMF에서 가장 약한 IMF로 순위 :
- 에탄올 및 암모니아
- 물과 염화 칼륨
- 옥탄 및 메탄
- 클로로포름과 아세톤
2. 다음 순수한 물질을 가장 높은 끓는점에서 가장 낮은 끓는점에서 순위 :
- 프로판
- 물
- 디클로로 메탄
분자간 힘 :솔루션 :
1. 각 화합물 쌍 사이의 가장 강력한 상호 작용을 찾으십시오.
- 물과 염화 칼륨
이 두 가지는 극성 분자와 이온 성 화합물이므로 이온 다이폴 력이 그들 사이에 존재합니다. 이것들은 일반적으로 가장 강력한 분자간 힘입니다. - 에탄올과 암모니아
이들은 둘 다 극성 분자이므로 쌍극자 쌍극자 힘을 가지고 있지만, 더 중요한 것은 수소 결합이 가능하며, 이는 일반적인 쌍극자 쌍극자 상호 작용보다 강력합니다.
. - 클로로포름과 아세톤
이들은 수소 결합에 관여 할 수없는 극성 분자이다. 그들은 쌍극자 쌍극자 상호 작용을 가지고 있습니다. - 옥탄과 메탄은 모두 비극성 분자이므로 런던 분산 힘 만 있습니다. 이것들은 가장 약한 IMF입니다.
참고 : 모든 물질에는 다른 IMF 외에도 런던 분산 세력이 있음을 기억하십시오!
2. 끓는점은 IMF 강도와 관련이 있습니다. IMF가 강할수록 끓는점이 높아집니다.
- 물은 최고 을 가지고 있습니다 끓는점은 쌍극자 쌍극자 힘과 수소 결합에 참여하기 때문에
- 디클로로 메탄은 쌍극자 쌍극자 힘에 참여하기 때문에 다음으로 최고입니다.
- 프로판은 최저 을 갖는다 런던 분산 세력에만 참여하기 때문에 끓는점.