이온 쌍 및 이온 성 화합물 :
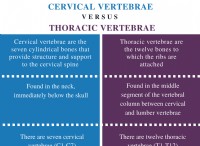
이온 쌍 :
* 이온 쌍은 양으로 하전 된 이온 (양이온) 가 형성됩니다. 및 A 음으로 하전 된 이온 (음이온) 정전기력에 의해 서로 끌어옵니다.
* 용액이나 기체에 존재할 수 있습니다.
* 그들은 안정적이고 중성 화합물이 아닙니다 ; 그들은 단순히 서로 끌리는 두 이온입니다.
이온 성 화합물 :
* 이온 성 화합물은 금속 일 때 형성된다 (양이온) 및 비 금속 (음이온) 교환 전자 안정적인 중성 화합물을 형성하기 위해 .
* 이온 성 화합물에 대한 공식 전기 중립을 달성하는 데 필요한 양이온 대 음이온의 비율을 반영합니다.
*이 비율은 전하 에 의해 결정됩니다 관련된 이온의.
예 :
나트륨 (NA) 및 염소 (CL)
* 이온 쌍 : na⁺와 cl attract은 서로 끌어 이온 쌍 (na⁺cl⁻)을 형성합니다.
* 이온 성 화합물 : 염화나트륨 (NaCl).
이온 성 화합물에 대한 공식을 작성하는 방법은 다음과 같습니다.
1. 이온의 전하를 결정하십시오.
* 나트륨 (NA)은 그룹 1 금속이므로 +1 이온 (Na⁺)을 형성합니다.
* 염소 (CL)는 그룹 17 비금속이므로 -1 이온 (Cl⁻)을 형성합니다.
2. 중성 화합물을 초래할 이온의 가장 작은 비율을 찾으십시오. .
*이 경우, 하나의 나트륨 이온 (Na⁺)은 하나의 클로라이드 이온 (Cl⁻)과 결합하여 중성 화합물을 형성합니다.
3. 먼저 양이온의 기호를 사용하여 공식을 작성하고 음이온을 씁니다. .
* 염화나트륨의 공식은 naCl 입니다 .
다른 예 :
* 칼슘 (Ca) 및 산소 (O) :
* ca는 ca²x를 형성하고 o는 o ²⁻을 형성하므로 공식은 cao 입니다. .
* 마그네슘 (mg) 및 질소 (N) :
* mg은 mg² ⁺를 형성하고 n은 n³⁻를 형성하므로 공식은 mg ₃n₂ 입니다. .
기억하십시오 : 이온 성 화합물에 대한 공식은 중성 화합물을 초래하는 양이온 및 음이온의 가장 작은 전수 비율을 반영합니다.