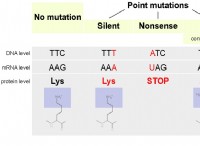
Nernst 방정식 이해
수소 전극의 전위는 nernst 방정식에 의해 결정됩니다.
E =E ° + (RT/NF) * LN (Q)
어디:
* e 전극 전위입니다
* e ° 표준 전극 전위 (표준 수소 전극의 경우 0.00V)입니다.
* r 이상적인 가스 상수입니다 (8.314 j/mol · k)
* t Kelvin의 온도입니다 (표준 조건의 경우 298 K를 가정)
* n 반 반응에서 전달 된 전자의 수 (수소 전극의 경우 1)
* f 파라데이의 상수 (96,485 c/mol)
* Q 반응 지수입니다
수소 전극에 nernst 방정식을 적용
수소 전극의 반 반응은 다음과 같습니다.
2H⁻ + 2E 2 → H₂
반응 지수 (Q)는 다음과 같습니다.
Q =[HAT] / [HAT] ²
우리는 표준 수소 전극을 다루고 있기 때문에 H₂의 압력은 1 atm이며 [h₂] 용어를 무시할 수 있습니다. 따라서 Q =1 / [H⁺] ².
잠재력 계산
1. pH 및 [HAT] : pH =-log [H⁺]이므로 수소 이온 농도를 찾을 수 있습니다.
[h⁻] =10 ¹⁰ m
2. Nernst 방정식으로 대체 :
e =0.00 V + (8.314 J / mol · K * 298 K / (1 * 96,485 C / mol)) * ln (1 / (10 ¹⁰) ²)
e =0.00 V + (0.0257 V) * ln (10²⁰)
E =0.00 V + (0.0257 V) * (46.05)
e ≈ 1.18 v
따라서, pH 10의 용액과 접촉하는 수소 전극의 잠재력은 대략 1.18 v. 이다.
중요한 참고 : 이 계산은 표준 조건 (298K, 1 ATM H₂)을 가정합니다. 실제로, 온도와 수소 압력의 변화에 따라 잠재력은 약간 달라집니다.