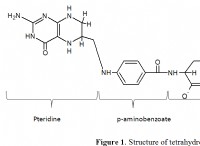
1. 루이스 구조를 그립니다
* 탄소 : 4 개의 원자가 전자가 있습니다
* 수소 : 원자가 전자가 1 개 있습니다
* 염소 : 7 개의 원자가 전자가 있습니다
cishlcl의 루이스 구조는 다음과 같습니다.
시간
|
H -C =C -CL
|
시간
2. 단일, 이중 및 트리플 본드를 식별하십시오
* 단일 채권 : 각 단일 결합은 하나의 시그마 (σ) 결합을 나타냅니다.
* 이중 채권 : 각각의 이중 결합은 하나의 시그마 (σ) 결합 및 하나의 PI (π) 결합을 나타낸다.
* 트리플 본드 : 각 트리플 결합은 하나의 시그마 (σ) 결합 및 2 개의 PI (π) 결합을 나타냅니다.
3. 채권을 계산하십시오
* Sigma Bonds (σ) : 5 개의 단일 결합 (C-H, C-C, C-Cl)과 1 개의 이중 결합 (C =C)이 있으며, 총 6 Sigma Bonds 를 제공합니다. .
* pi bonds (π) : 하나의 이중 결합 (C =C)이 있으며 총 1 Pi Bond 를 제공합니다. .
따라서 C ,hlcl은 6 개의 Sigma Bonds와 1 Pi Bond를 가지고 있습니다.