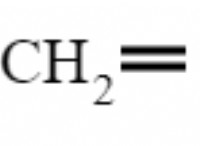* kmno4는 강한 산화제입니다 : 전자를 쉽게 받아들이면 다른 물질이 전자를 잃게됩니다 (산화).
* 기본 조건은 산화를 선호합니다 : 기본 조건에서, 피망산 이온 (MNO4-)은 갈색 침전물 인 이산화 망간 (MNO2)으로 감소된다. 이 환원 반응은 기본 솔루션에서 더 유리합니다.
* 특정 반응 : 기본 솔루션에서 KMNO4는 산화 될 수 있습니다.
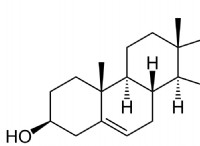
* 알코올 : 1 차 알코올은 카르 복실 산으로 산화되는 반면, 2 차 알코올은 케톤으로 산화된다.
* Alkenes : KMNO4는 이중 결합을 절단하여 바로 디올 (인접한 탄소상의 2 개의 하이드 록실기)을 형성 할 수있다.
Naoh의 작동 방식 :
* 산성 부산물 중화 : KMNO4와의 일부 산화 반응은 산성 부산물을 생성합니다. NAOH는 이러한 산을 중화시켜 기본 환경을 유지합니다.
* 수산화 이온 제공 : mno4- mno2의 감소를 위해서는 오하 이온이 필요하다.
예 :
기본 조건에서 KMNO4를 사용하여 알코올을 카르 복실 산으로의 산화시 :다음 반응이 발생합니다.
```
3 [CH3CH2OH] + 2 [KMNO4] + H2O → 3 [CH3COOH] + 2 [MNO2] + 2 [KOH]
```
이 반응에서, NAOH는 기본 환경을 유지하기 위해 솔루션에 추가되어 반응이 효과적으로 진행되도록 할 것이다.
참고 : 산성 조건에서, KMNO4는 무색 인 Mn2+ 이온으로 감소된다. 이것은 많은 산화 반응에 산성 환경을 덜 적합하게 만듭니다.