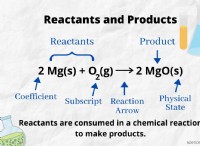
다음은 고장입니다.
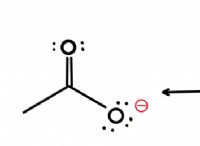
* 전자 친화력 : 이것은 전자가 기체 상태의 중성 원자에 첨가되어 음의 이온을 형성 할 때 에너지의 변화입니다.
* 분리 된 가스 상 원자 : 이것은 원자가 다른 원자 나 분자와 상호 작용하지 않음을 의미합니다.
* 에너지 공개 : 전자 친화도는 일반적으로 전자가 원자에 첨가 될 때 에너지가 방출되기 때문에 음의 값으로 표현됩니다. 더 음의 값은 더 높은 전자 친화력을 나타내며, 이는 원자가 전자에 대해 더 강한 인력을 갖는다는 것을 의미한다.
예 :
염소의 전자 친화력은 -349 kJ/mol입니다. 이는 기체 상태에서 1 몰의 염소 원자가 각각 하나의 전자를 얻기 위해 염화 이온 (Cl-)을 형성 할 때 349 kJ의 에너지가 방출된다는 것을 의미한다.
참고 :
* 모든 원자가 양의 전자 친화력을 갖는 것은 아닙니다. 고귀한 가스와 같은 일부 원자는 실제로 전자를 첨가하기 위해 에너지가 필요합니다.
* 전자 친화력은 화학 결합 및 반응성을 이해하는 데 중요한 개념입니다.