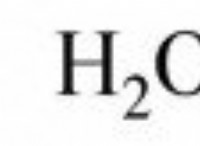1. 이온 성 화합물 :
* 소금 : 이들은 산과 염기의 반응으로 형성된다. 그들은 물에 완전히 분리되어 이온을 생성합니다. 예 :NaCl (테이블 소금), KBR, CACL₂, MGSO₄.
* 금속 수산화물 : 이들은 또한 이온으로 완전히 분리하는 기초입니다. 예 :NaOH (수산화 나트륨), KOH (수산화 칼륨).
* 금속 산화물 : 이들이 물에 용해 될 때, 그들은 금속 수산화물을 형성하기 위해 반응합니다. 예 :CAO (산화 칼슘)는 물과 반응하여 Ca (OH) ₂를 형성합니다.
2. 강산 :
* 강산은 물에서 완전히 이온화됩니다. 예 :HCl (염산), HNO₃ (질산), HASSOA (황산).
3. 강한베이스 :
* 강한베이스는 물에서 완전히 이온화됩니다. 예 :NaOH (수산화 나트륨), KOH (수산화 칼륨).
중요한 메모 :
* 약산 및 염기 : 이들은 부분적으로 단지 물에서 이온화되므로 이온이 적고 전기를 덜 효과적으로 전도한다는 것을 의미합니다. 예 :Choocooh (아세트산), NH₃ (암모니아).
* 공유 화합물 : 일반적으로 공유 화합물은 물에서 이온화되지 않으므로 전기를 전도하지 않습니다. 예 :설탕 (c (h₂₂o₁₁), 에탄올 (c₂h₅oh).
키 테이크 아웃 : 전기를 전도하는 솔루션의 능력은 유리 이온의 존재에 달려 있습니다. 물에서 완전히 이온화되는 용질은 강한 전해질이며 전기를 잘 전달합니다. 부분적으로 만 이온화하는 용질은 전해질이 약한 전기 물질이며 전기를 제대로하지 못한다. 전혀 이온화되지 않는 용질은 전해질이 아니며 전기를 전도하지 않습니다.