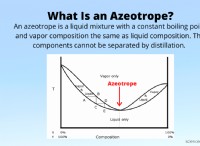
고장은 다음과 같습니다.
* 용질의 질량 : 이것은 용액에 용해 된 물질의 양이며, 일반적으로 그램 (g)으로 표현됩니다.
* 용질의 두부 : 이것은 각도의 물질의 양이며, 이는 특정 수의 분자를 나타냅니다 (6.022 x 10^23).
* 용액의 부피 : 이것은 일반적으로 리터 (L)로 발현되는 용질 및 용매를 포함하여 용액의 총 부피입니다.
관계 :
* Molarity (m) : 몰토리티는 농도를 발현하는 가장 일반적인 방법이며 용액의 리터당 용질의 몰로 정의됩니다.
* 공식 : Molarity (M) =용질의 두더지 / 용액의 부피 (L)
* molality (m) : 몰은 용매 킬로그램 당 용질의 두부 수로 정의된다.
* 공식 : Molality (M) =용질의 두더지 / 용매의 질량 (kg)
키 포인트 :
* 몰비와 몰은 농도를 표현하는 두 가지 방법이며, 그 차이를 이해하는 것이 중요합니다.
* 위의 공식을 사용하여 다른 두 개를 알고 있다면이 수량을 계산할 수 있습니다.
예를 들어, 용질의 질량과 용액의 부피를 알고 있다면 어금니를 계산할 수 있습니다.
* 용액의 몰라도와 부피를 알고 있다면 용질 몰을 계산할 수 있습니다.
예 :
58.44g의 NaCl (염화나트륨)이 1 L의 물에 용해된다고 가정 해 봅시다.
1. NaCl의 두더지를 계산합니다 :
* NaCl의 분자량 =58.44 g/mol
* NaCl의 몰 =58.44 g / 58.44 g / mol =1 mol
2. 은밀도 계산 :
* Molarity =1 mol / 1 l =1 m
따라서 NaCl 용액의 농도는 1 M입니다.