1. 화학 결합 :
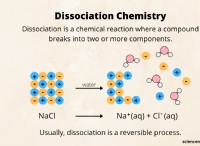
* 이온 결합 : 이것은 원자가 전자를 얻거나 잃어 버릴 때 발생합니다. 반대로 하전 된 이온은 서로를 끌어내어 이온 성 화합물을 형성합니다. 예를 들어, 염화나트륨 (NaCl)은 나트륨 (NA)이 Na+가되어 전자를 잃고 염소 (CL)가 전자를 얻기 위해 전자를 얻을 때 형성된다.
* 공유 결합 : 이것은 원자가 전자를 공유하여 안정적인 분자를 형성 할 때 발생합니다. 예를 들어, 물 (H2O)은 2 개의 수소 원자가 각각 산소 원자와 전자를 공유 할 때 형성된다.
* 금속 결합 : 이는 전자가 전체 금속 구조 전체에서 비편성되고 공유되는 금속 원자 사이에서 발생합니다. 이것은 좋은 전도도와 같은 강한 유대와 특성을 초래합니다.
2. 화학 반응 :
* 반응물 : 화학적 변화를 겪는 시작 물질.
* 제품 : 새로운 물질은 화학적 변화의 결과로 형성되었습니다.
* 에너지 변화 : 화학 반응은 에너지 (발열)를 방출하거나 에너지 (흡열)가 발생할 수 있습니다.
* 반응 조건 : 온도, 압력 및 촉매의 존재와 같은 요인은 반응의 속도와 결과에 영향을 줄 수 있습니다.
3. 분자 구조 :
* 모양과 형상 : 분자 내에서 원자의 공간 배열은 그 특성 및 반응성을 결정할 수있다.
* 기능 그룹 : 분자 내의 특정 원자 그룹은 종종 화학적 거동을 결정합니다.
4. 열역학 :
* 엔탈피 (ΔH) : 반응 동안 열 에너지의 변화.
* 엔트로피 (ΔS) : 반응 동안 장애 또는 무작위성의 변화.
* 깁스 자유 에너지 (ΔG) : 반응의 자발성 측정.
5. 동역학 :
* 반응 속도 : 반응이 얼마나 빨리 진행되는지.
* 활성화 에너지 : 반응물이 에너지 장벽을 극복하고 반응을 시작하는 데 필요한 최소 에너지.
예 :
* 불타는 나무 : 연소는 목재 (셀룰로오스)와 산소 사이의 화학 반응을 포함하여 이산화탄소, 물 및 에너지를 생산합니다.
* 케이크 베이킹 : 밀가루, 설탕, 계란 및 버터와 같은 성분을 혼합하면 화학 반응으로 이어지면 질감과 맛이 다른 새로운 물질을 만듭니다.
* 철의 녹슬 : 철은 산소 및 물과 반응하여 산화철 (녹)을 형성합니다.
결론적으로, 새로운 물질을 형성하기위한 물질의 조합은 화학 결합, 반응 동역학, 열역학 및 분자 구조의 기본 원리에 의해 주도된다. 이러한 요인들은 원자가 자신을 재배치하고 다른 배열을 형성하는 방법을 결정하여 고유 한 특성을 가진 다양한 물질을 이끌어냅니다.