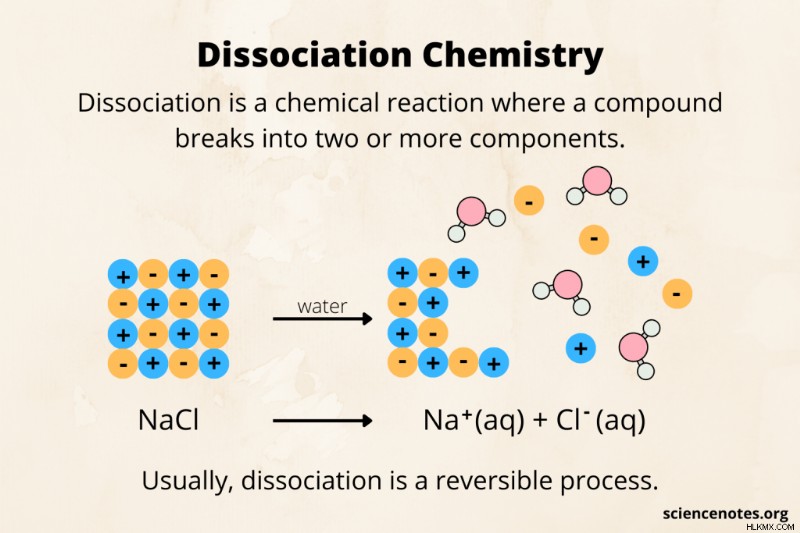
화학에서 해리 분자 또는 화합물이 이온, 원자 또는 라디칼과 같은 작은 조각으로 파괴되는 화학 반응입니다. 예를 들어, 염산 (HCl)은 물에 분리되어 H 및 Cl 이온을 형성합니다. 일반적으로 해리는 가역적 과정입니다. 해리의 반대는 연관 입니다 또는 재조합 .
해리 공식
해리에 대한 일반적인 공식은 반응입니다.
ab/a + b
반응 화살표는 반응이 가역적임을 나타냅니다. 대부분의 경우 반응은 양이온과 음이온을 형성합니다.
ab/a + b
일부 화합물에서는 두 개 이상의 조각으로 부서집니다.
해리 반응 예
해리 반응의 예는 다음과 같습니다.
- naCl (s) ⇄ na (aq) + cl (aq)
- HCl cl H (aq) + Cl (aq)
- h 2 그래서
4 ⇄ 2h (aq) + so 4 (aq) - fe 2 (so
4 ) 3 (s) fe 2fe (aq) + 3SO 4 (aq) - 2 h 2 o 3 h 3 O + + OH
분자 해리가 이온 생성물을 형성 할 때, 반응의 또 다른 이름은 이온화 입니다. . 대회에 의해, 물은 수용액의 반응을위한 생성물로 나열되지 않습니다. 대신, 약어 (AQ)는 제품 공식을 따릅니다.
가스는 또한 해리를 겪습니다. 예를 들어, 테트 록 사이드 (n <<서브> 2 o 4 ) 이산화 질소에 분리됩니다 (NO
n 2 o 4 ⇄ 2 No 2
일부 화합물에는 해리에 관한 옵션이 있으며 다양한 제품을 형성 할 수 있습니다. 예를 들어 azo- t 부탄은 3 개의 가능한 해리 반응을 겪고 이온화 된 부틴을 형성하고, t -부틸 양이온과 중성 라디칼, 또는 다른 양이온과 중성 t -부틸 라디칼.
해리 상수
모든 화합물이 분리되면, 이것은 완전한 해리입니다. 강한 전해질은 물에서 완전한 해리를 겪습니다. 강한 전해질의 예로는 강산, 강한 염기 및 소금이 포함됩니다. 그러나 불완전한 해리가 일반적입니다. 불완전한 해리는 원래 화합물의 일부뿐만 아니라 일부 작은 입자를 함유하는 혼합물을 초래한다. 불완전한 해리는 약한 전해질로 발생합니다. 약한 전해질에는 약산 및 염기 및 더 많은 유기 화합물이 포함됩니다.
용해도는 해리 된 생성물의 양에 영향을 미칩니다. 예를 들어, 일부 소금은 거의 불용성이지만 강한 전해질입니다. 예를 들어, 염화은 (AGCL)은 강한 전해질이지만 실제로는 물에 불용성입니다. 포화 AGCL 용액에는 약 1.3 x 10m의 Ag 및 Cl 이온 만 포함되어 있습니다!
해리의 정도 (α)는 성분으로 분해되는 화합물의 분율입니다. 예를 들어, 완전한 해리는 1의 해리도 1입니다. 화합물 해리의 절반이면 해리 정도는 0.5입니다. 해리가 발생하지 않으면 해리 정도는 0입니다.
Van't Hoff Factor ( i 해리 정도 (α)와 형성된 입자의 몰수 (n) 사이의 관계를 설명합니다 (n) :
i =1 + α (n - 1)
예를 들어, 염화나트륨의 해리를 고려하십시오 :
naCl + na + cl
1 몰의 NaCl은 2 몰의 생성물 (1 몰 NA + 1 몰 Cl)을 생성합니다. 그래서, n =2.
i =1 + α (n - 1) =1 + α (2 - 1) =1 + α
α =i - 1
해리 상수
화학적 평형에서 가역적 해리를 위해, 해리 상수 (k d )는 해리 화합물의 비율이 너무 해제되지 않은 화합물이다. 괄호는 각 화학 종의 평형 농도를 나타냅니다.
ab/a + b
k d =[a] [b] / [ab]
참조
- Atkins, P.; De Paula, J. (2006). 물리 화학 (8th ed.). 와트시. 자유민. ISBN 978-0-7167-8759-4.
- Laidler, K.J. (1978). 생물학적 응용 분야의 물리 화학 . 벤자민/커밍스. ISBN 978-0-8053-5680-9.
- Petrucci, Ralph H.; Harwood, William S.; 청어, F. Geoffrey (2002). 일반 화학 :원리 및 현대 응용 (8th ed.). 상단 새들 강, 뉴저지 :프렌 티스 홀. ISBN 978-0-13-014329-7.