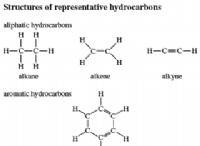
해당 책이 있으면 문제에 접근하는 방법은 다음과 같습니다.
1. caCl₂ :에서 Cll의 두더지를 계산하십시오
* cacl₂의 두더지 : 0.250 l * 0.20 mol/l =0.050 몰스 CaCl₂
* caCl₂에서 Cll의 두더지 : 0.050 몰스 CACLAL * 2 몰 CLAL/1 몰 CACL₂ =0.100 몰 CL⁻
2. Kcl에서 Cll의 두더지를 계산하십시오 :
* KCl 용액의 부피 : 이 책이 'V'리터라고 가정 해 봅시다.
* Kcl의 두더지 : v l * 0.40 mol/l =0.40V 몰스 KCl
* kcl에서 Cll의 두더지 : 0.40V 몰스 KCl * 1 몰 CL⁻/1 몰 KCl =0.40V 몰스 CL⁻
3. Cl⁻의 총 두더지를 계산하십시오 :
* Cl⁻의 총 두더지 : 0.100 몰 + 0.40V 몰
4. Cl⁻의 최종 농도를 계산하십시오 :
* 총 부피 : 0.250 L + V l
* Cl⁻의 최종 농도 : (0.100 몰 + 0.40V 몰) / (0.250 L + V L)
예 :
KCl 용액의 부피가 100 ml (0.100 L)라고 가정 해 봅시다.
* kcl에서 Cll의 두더지 : 0.100 l * 0.40 mol/l =0.040 몰스 CL⁻
* Cl⁻의 총 두더지 : 0.100 몰 + 0.040 몰 =0.140 몰
* 총 부피 : 0.250 l + 0.100 l =0.350 l
* Cl⁻의 최종 농도 : 0.140 몰 / 0.350 l = 0.40 m
문제에서 'V'를 실제 KCL 솔루션의 실제 볼륨으로 바꾸는 것을 잊지 마십시오. .