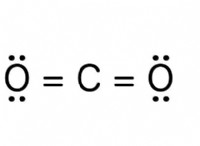이온화 에너지 이해
* 이온화 에너지 기체 상태의 원자에서 전자를 제거하는 데 필요한 에너지입니다.
* 이온화 에너지가 낮을수록 원자가 전자를 잃을 수 있습니다.
주기적인 트렌드
* 기간 (왼쪽에서 오른쪽) : 이온화 에너지는 일반적으로 증가합니다. 이것은 핵의 양성자 수가 증가하여 전자를 더 가깝게 당기고 제거하기가 더 어려워지기 때문입니다.
* 그룹 아래로 (위에서 아래로) : 이온화 에너지는 일반적으로 감소합니다. 가장 바깥 쪽 전자가 핵에서 멀어지고 매력이 덜 경험되기 때문입니다.
요소 분석
* al (알루미늄) : 그룹 13, 기간 3
* Cl (염소) : 그룹 17, 기간 3
* na (나트륨) : 그룹 1, 기간 3
* Zn (아연) : 그룹 12, 기간 4
결론
* 나트륨 (NA) 전자를 가장 쉽게 잃게됩니다.
* 추론 : 나트륨은 그룹 1 (알칼리 금속)에 위치하며, 이는 +1 양이온을 형성하기 위해 하나의 전자를 쉽게 잃는 것으로 알려져 있습니다. 또한 주기적 표에서의 위치로 인해 주어진 요소 중에서 가장 낮은 이온화 에너지를 갖습니다.
이온화 에너지 또는 정기 트렌드에 대한 자세한 내용을 원하시면 알려주세요!