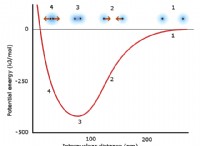
1. 이온화 에너지 : 나트륨은 우라늄보다 이온화 에너지가 훨씬 낮습니다. 이는 나트륨 원자에서 전자를 제거하는 데 에너지가 적어 전자를 잃고 양이온이 될 가능성이 높아집니다. 반면에 우라늄은 전자를 더 단단히 고정시켜 양의 이온을 형성 할 가능성이 줄어 듭니다.
2. 금속 특성 : 나트륨은 반응성이 높은 알칼리 금속이며, 우라늄은 전이 금속입니다. 알칼리 금속은 강한 금속성 특성으로 유명하며, 이는 전자와 양이온을 쉽게 잃는 것을 의미합니다. 전이 금속은 여전히 금속성이지만 더 넓은 범위의 산화 상태를 나타내며 일반적으로 알칼리 금속보다 반응성이 떨어집니다.
3. 전자 구성 : 우라늄은 부분적으로 채워진 f- 궤도와 복잡한 전자 구성을 가지고 있습니다. 이 전자 구성은 비교적 안정적인 특성에 기여하여 다른 요소와 쉽게 반응 할 가능성이 적습니다.
4. 원자 크기 : 우라늄은 나트륨보다 더 큰 원자입니다. 이 큰 크기는 우라늄이 전자를 잃는 것이 더 어렵고 외부 전자가 핵에서 멀어지고 매력을 덜 경험하기 때문에 전자를 잃는 것이 더 어렵습니다.
5. 차폐 효과 : 우라늄은 나트륨보다 더 많은 전자 껍질을 가지고 있습니다. 이로 인해 내부 전자가 외부 전자의 핵의 인력을 차단하여 전자를 잃을 가능성이 줄어 듭니다.
요약 : 낮은 이온화 에너지, 더 강한 금속 특성, 더 안정적인 전자 구성, 더 큰 원자 크기 및 더 큰 차폐 효과의 조합은 모두 우라늄보다 훨씬 더 반응성이 높은 나트륨에 기여합니다.