화학적 결합에 대한 아이디어는 1916 년 W. Kossel과 G.N에 의해 처음 제안되었습니다. 남자 이름. 그들은 모든 고귀한 가스가 외부 껍질을 제외하고 외부 껍질에 8 개의 전자를 유지한다는 것을 발견했습니다. 여기서 외부 껍질에는 2 개의 전자 만 존재합니다. 그들은 또한 다른 모든 요소들이 화합물을 형성 할 때 전자를 잃거나, 얻거나 공유함으로써 고귀한 가스의 구성을 달성하려고 시도했다고 제안했다. 이것은 화학 결합이 어떻게 형성되는지에 대한 초기 개념의 기초였습니다.
이 기사는
를 봅니다
1. 다른 유형의 화학적 결합은 무엇입니까
- 이온 결합
- 공유 결합
- 금속 결합
2. 공유 결합은 어떻게 형성되는지
다른 유형의 화학적 결합
화학적 결합의 세 가지 주요 유형이 있습니다 :이온, 공유, 금속. 결합 유형은 전자 수와 원자 궤도에서 전자의 배열에 의존한다. 또한, 수소 결합, 쌍극자 결합 및 분산 결합을 포함하는 분자간 결합이라는 다른 유형의 결합이 있습니다.
이온 결합 금속 원자가 전자를 비금속 원자에 제공 할 때 발생합니다. 따라서, 이온 결합은 금속과 비금속 사이에서 발생합니다 (예 :염화나트륨)
공유 결합 두 원자 사이의 원자가 전자 공유를 통해 발생합니다.
금속 결합 공유 결합과 상당히 유사합니다. 그러나 공유 결합과 달리 원자를 함께 유지하는 원자가 전자는 금속 격자 안에서 자유롭게 움직입니다.
이제 공유 채권이 어떻게 형성되는지 봅시다.
공유 결합은 어떻게 형성되는지
공유 결합은 두 개의 비금속 원자가 전자를 공유하여 고귀한 가스 전자 구성을 달성 할 때 발생합니다. 전자를 주거나받는 대신 각 원자는 외부 궤도를 겹쳐서 전자를 공유합니다. 이 공유 전자는 원자가 전자라고합니다. 공유 전자에 대한 두 개의 양으로 하전 된 핵 사이의 동시 힘은 두 원자를 함께 유지합니다. 단일, 이중 및 삼중 결합은 공유 화합물에서만 볼 수 있습니다. 단일 공유 결합은 단일 전자 쌍이 관련 될 때 발생합니다. 이 경우 각 원자는 단일 전자를 공유합니다. 이중 결합은 두 쌍의 전자가 관여 할 때 발생합니다. 이 경우, 각 원자는 결합에 대해 2 개의 전자를 제공합니다. 트리플 본드를 형성 할 때 3 쌍의 전자가 관여합니다. 삼중 결합에서 각 원자는 외부 껍질에 3 개의 전자를 공유합니다. 공유 결합에 의해 형성된 분자를 공유 분자라고한다. 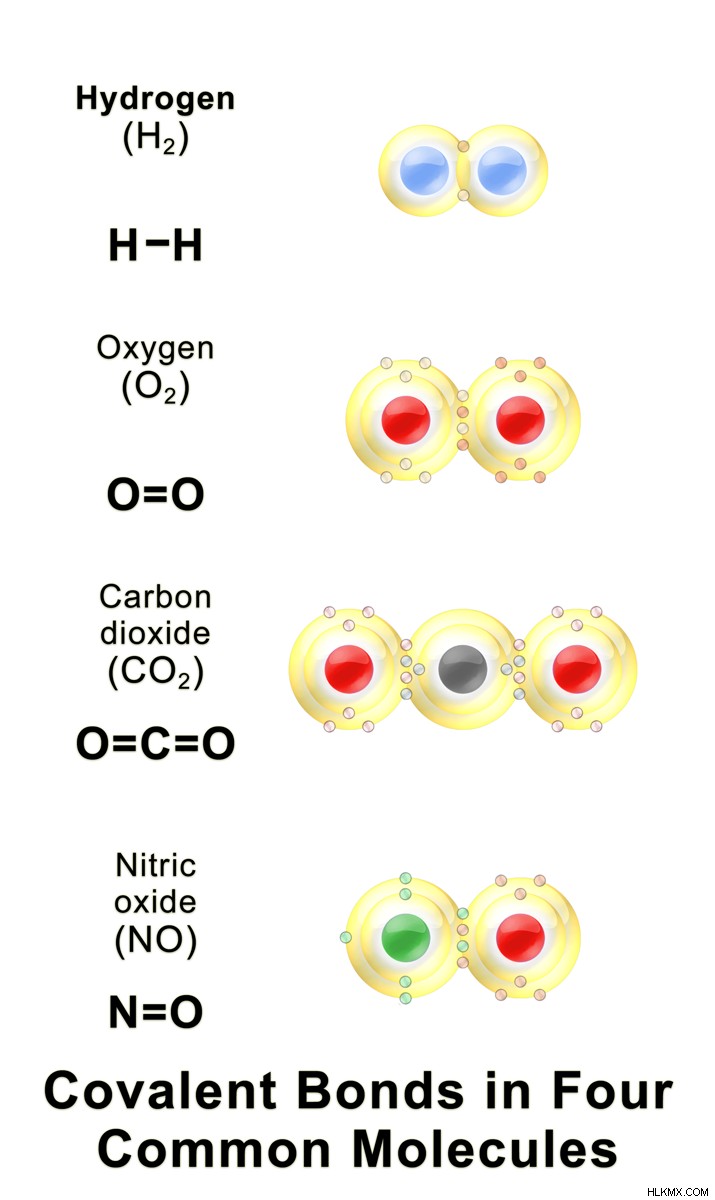
공유 화합물은 전자를 공유하기 때문에 많은 유사한 특성을 가지고 있습니다. 모든 공유 고체는 결정질 고체와 비정질 고체의 두 가지 범주로 분류 될 수 있습니다. 결정질 고체는 단단한 재료입니다. 다이아몬드는 결정질 고체의 예이며 지구상에서 가장 어려운 재료입니다. 비정질 고체는 매우 단단한 고체가 아닙니다. 공유 물질에서 자유 전자 부족으로 인해 전기를 수행 할 수 없습니다. 따라서, 공유 화합물은 좋은 절연체 인 것으로 알려져있다. 공유 화합물의 일반적인 예로는 수소 가스, 산소 가스, 이산화탄소 가스, 메탄, 이산화탄소, 다이아몬드 등이 있습니다.
참조 :
버튼, 조지. 화학 아이디어 - Salters Advanced Chemistry . vol. 4. N.P. :Heinemann, 2000. 인쇄.West, Krista. 화학 반응의 기초 . N.P. :The Rosen Publishing Group, 2013. Print.
마이어스, 리차드. 화학의 기초 . N.P. :Greenwood Publishing Group, 2003. 인쇄.