| | 전기 음성
| 3.98 |
불소에는 2p 쉘에 5 개의 전자가 있습니다. 이 때문에 불소가 가장 전기 음성 요소라는 것을 알고 있습니다. 2p의 전자 구성. 궤도에는 총 6 개의 전자가 포함되어 있으며 불소가 이상적인 전자 구성에 매우 가깝게 보이게합니다. 높은 전기성은 불소의 작은 반경을 추가로 설명합니다. 전자는 핵으로 닫히기 때문에. 양성 양성자는 음성 전자에 강한 인력을 가지며, 더 크고 덜 전기 음성 요소에 비해 핵에 밀접하게 손상되지 않습니다.
. 가스 플루오로 카본에 익숙 할 수 있습니다. 이들은 이산화탄소보다 지구 온난화에 더 큰 영향을 미치는 온실 가스입니다 .SF6은 알려진 물질의 지구 온난화가 가장 높습니다. 탄소 - 플루오린 결합의 강도로 인해, 유기 플루오린 화합물은 주변에서 지속될 수있다. 포유 동물에서 발견 된 불소의 알려진 대사 역할은 없습니다.
f2의 결합 에너지는 Cl2 또는 Br2의 결합 에너지보다 훨씬 낮습니다. 이것은 높은 전기 음성 성 외에도 불소 해리, 높은 반응성 및 비 플루오린 원자에 대한 강한 결합의 이유입니다.
불소의 높은 전기 음성으로 인해 다른 원자로 형성된 결합은 매우 강력합니다.
마찬가지로, 분말 강철, 유리 조각 및 석면 섬유와 같은 물질조차도 저온에서 불소 가스와 빠르게 반응합니다. 불소는 지구의 지각에서 가장 흔한 요소로 13 번째 장소를 차지합니다. 불소는 자연에서 발생하지 않는 것으로 여겨지지만, 원소 불소는 존재하는 것으로 알려져있다.
유기 및 무기 물질을 포함하여 불소의 반응에서 풍부한 화학이 발견됩니다. 불소는 거의 모든 고귀한 가스, 금속성, 금속 및 비금속과 결합됩니다. 그것은 독점적으로 -1의 산화 상태를 차지합니다.
불소의 반응은 다음과 같습니다.
불소는 수소와 즉시 반응하여 화합물 수소 불화물을 형성합니다. 이 반응은 특정 조건에서 폭발 할 수 있습니다.
h2 (g) + f2 (g) → 2 hf (g)
HF는 또한 불소 CAF2의 황산과의 흡열 반응에 의해 생성됩니다 :
CAF2 + H2SO4 → 2 HF (g) + CASO4
형성된 화합물 인 HF는 비료 생산의 부산물로, 그 결과, 16 진 플루오로 실산 H2SIF6을 생성합니다. 불소의 높은 전자 친화력은 이온 결합에 대한 선호도를 나타낸다. 불소에 의해 형성된 공유 결합은 극성이며, 거의 항상 단일 인 것으로 밝혀졌다. 이것은 가수 분해에 의해 열적으로 HF를 방출하도록 저하 될 수있다 :
h2sif6 → 2 hf + sif4
sif4 + 2 H2O → 4 HF + SIO2
플루오린의 금속/금속 이온 반응
나트륨, Na는 불소, F2 형성 불소 나트륨, NAF와 반응합니다 :
2 na (s) + f2 (g) 2 naf (s)
상기 금속과의 반응은 대부분의 금속에 대해 수행 할 수있는 일반적인 반응입니다.
불소의 귀족 가스와의 반응
크립톤은 -196 ° C (액체 질소)의 매우 저온 온도로 냉각 될 때 불소 F2와 반응하고 전기 방전 또는 X- 선으로 시식을 뿌려 화합물, 크립톤 (II) 불소, KRF2
를 형성합니다. kr (s) + f2 (s) krf2 (s)
이 화합물은 실온으로 가열 될 때 분해됩니다.
Xenon은 불소, f2
와 반응합니다 xe (g) + 2 f2 (g) xef4 (s), 400 ° C에서 가스를 혼합 한 다음 -78 ° C로 냉각합니다
xe (g) + f2 (g) xef2 (s)
xe (g) + 3 f2 (g) xef6 (s)
Xenon 불소는 다른 크세논 화합물의 합성에 사용됩니다.
라돈은 불소 F2와 반응 할 수 있습니다. 분자의 정확한 공식은 알려지지 않았으며 일반적으로 rnfn
로 작성되었습니다. 불소의 황 반응
황은 과량의 불소 (vi) 불소와 반응 :
s (s) + 3 f2 (g) sf6 (s)
불소는 SO2 형성 SO2F2 :
와 반응합니다 so2 (g) + f2 (g) so2f2 (g)
불소의 물과의 반응
불소는 물과 반응합니다 :
f2 (g) + h2o (l) O2 (g) + of2 (aq) + h2o2 (aq) + hf (aq)
반응 조건은 반응의 균형을 결정합니다.
원소 불소는 약간 기본적입니다. 즉, 물과 반응 할 때 히드로 플루오르 산
를 형성 함을 의미합니다. 본질적으로 존재하지 않지만 인공 화합물에 사용됩니다.
알칼리 금속은 이온 성 및 고도로 가용성 모노 플루오 라이드를 형성합니다.
Polytetrafluoroethylene (PTFE), 구조 단위 –cf2-
와 폴리 에틸렌의 가장 간단한 플루오로 폴리머 및 퍼플 루오로 유사체 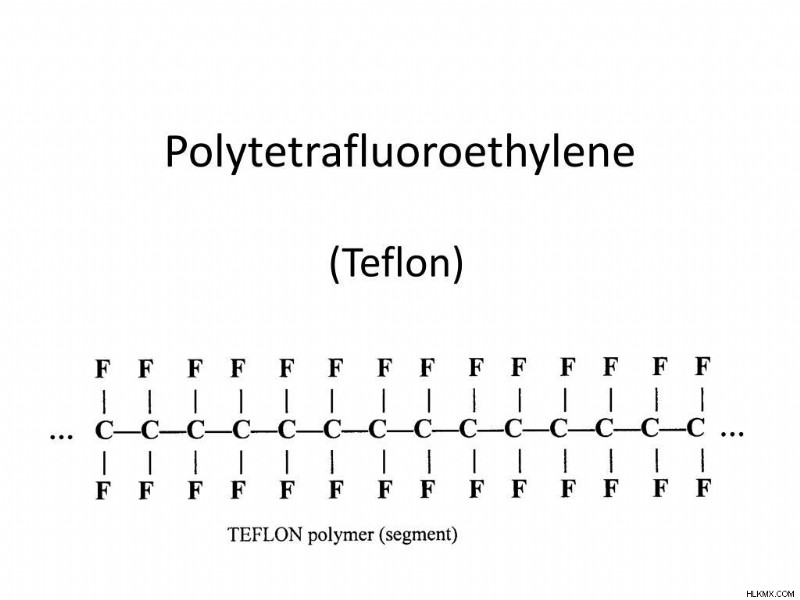
결론
이제 불소의 반응과 전기 음성이 얼마나되는지 알 수 있습니다. 그러나 일상 생활에서 불소가 우리 주변에 존재하는 곳을 알고 있습니까? 불소는 충치를 방지하기 위해 매일 도시 수도 공급 장치에 첨가됩니다. 불소 나트륨 (NAF), stannous (II) 불소, (SNF2) 및 나트륨 모노 플루오로 포스페이트 (NA2PO3F)는 치약에 첨가 된 모든 불소 화합물이며, 이는 또한 충치를 방지하는 데 도움이됩니다. 우라늄 헥사 플루오 라이드 (UF6)는 원자로에 사용되는 우라늄의 동위 원소를 분리하는 데 사용됩니다. 불소 및 플루오르 파르로도 알려진 CAF2, CAF2는 적외선에 집중하는 데 도움이되는 렌즈 제작에 사용됩니다. 불소는 주기율표의 특수 요소입니다.