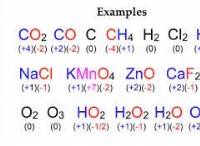
이유는 다음과 같습니다.
* pH 용액의 산도를 측정하고, pH가 낮은 것은보다 산성 용액을 나타냅니다.
* poh 더 낮은 POH는보다 기본적인 솔루션을 나타내는 솔루션의 염기성을 측정합니다.
이 두 값은 물의 이온 생성물 (kw) 와 관련이 있습니다. :
* KW =[H+] [OH-] =1.0 x 10^-14 at 25 ° C
어디:
* [H+]는 수소 이온 농도입니다
* [OH-]는 수산화물 이온 농도입니다
방정식의 양쪽의 음의 로그를 가져옵니다.
* -log (kw) =-log ([H+] [OH-])
* -log (kw) =-log [h+] -로그 [OH-]
* pkw =ph + poh
kw =1.0 x 10^-14이므로 pkw =14.
* ph + poh =14
중요한 참고 : 이 관계는 25 ° C에서 사실입니다. 온도가 다른 경우 KW의 값이 변하며, 따라서 pH 및 POH의 합도 변할 것입니다.