주요 차이 - 원자가 대 산화 상태
모든 화합물은 다른 원소의 원자로 만들어집니다. 이들 원자는 사용 가능한 자유 궤도의 수 또는 특정 원자가 방출 할 수있는 전자의 수에 따라 다른 비율로 결합된다. 원자가 및 산화 상태는 이러한 다른 원자 조합의 이유를 설명하는 데 사용되는 두 가지 용어입니다. 원자가와 산화 상태의 주요 차이점은 원자가는 특정 요소의 원자의 가장 바깥 쪽 쉘에 존재하는 전자의 수이며 산화 상태는 특정 화합물의 요소가 손실되거나 얻은 전자의 수입니다. .
주요 영역을 다루었습니다
1. 원자가
- 정의, 표시, 예
2. 산화 상태
- 정의, 표시, 산화 상태를 결정하기위한 규칙, 예
3. 원자가와 산화 상태의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 화합물, 요소, 쉘, 산화 상태, 원자가 
analency
밸런스는 특정 요소의 가장 바깥 쪽 쉘에 존재하는 전자 수로 정의 될 수 있습니다. 원자가는 특정 원자가 가질 수있는 최대 채권 수를 결정합니다. 주기율표의 요소는 원자가가 중성 및 기체 상태 일 때 원자가 가질 수있는 원자가 전자의 수 (가장 외부 궤도의 전자)에 따라 그룹화된다. 다음 표는 이것을 설명합니다.
| 요소
|
원자 번호
|
전자 구성
| 밸런스
|
|
나트륨 (NA)
|
11
|
1S2S2P3S
|
1
|
|
마그네슘 (mg)
|
12
|
1S2S2P3S
|
2
|
|
붕소 (b)
|
5
|
1S2S 2p
|
3
|
|
탄소 (c)
|
6
|
1S2S 2p
|
4
|
|
황 (s)
|
16
|
1S2S2P3S 3p
|
6
|
주기성 테이블에서 동일한 그룹의 요소는 원자가에 따라 요소가 그룹화되고 가장 바깥 쪽 쉘에 존재하는 전자 수는 전자 구성을 고려할 때 동일하기 때문에 동일한 원자가를 갖습니다.
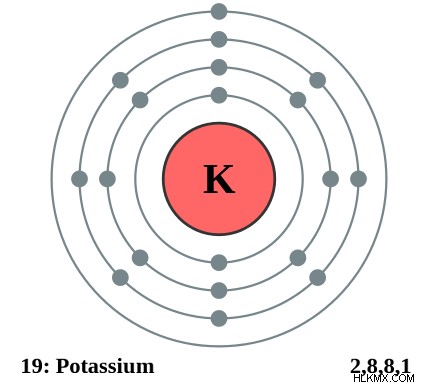
그림 1 :칼륨의 원자가는 1 입니다
산화 상태
산화 상태는 특정 원자가 다른 원자와 잃어버린 전자의 수로 정의 될 수 있습니다. 전자의 손실 또는 이득은 전자가 음전하되기 때문에 원자의 전하가 변경되고, 각각의 음전하는 핵에서 양성자의 양전하에 의해 중화된다. 원자가 전자를 잃거나 얻을 때 전기 전하의 불균형이 발생합니다. 따라서, 그 원자의 산화 상태는 그 원자의 전하이다. 산화 상태는 화합물에있는 원자의 전하를 설명하는 데 사용될 수 있습니다.
산화 상태는 숫자와 함께 양수 (+) 또는 음수 (-) 기호를 사용하여 제공됩니다. 기호는 해당 원자의 전하를 설명하고 그 숫자는 교환 된 전자의 수를 설명합니다.
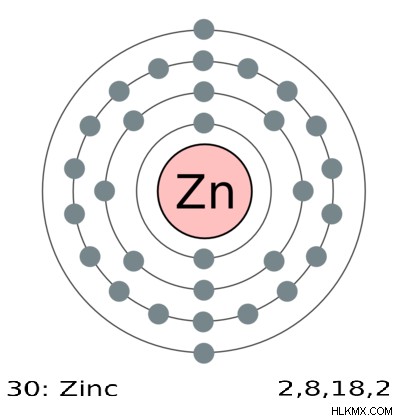
그림 2 :0 및 +2는 아연의 유일한 산화 상태 입니다.
산화 상태를 결정하는 방법
원자의 산화 상태는 7 가지 규칙에 따라 계산됩니다. 이러한 규칙과 산화 상태에 대한 몇 가지 예는 다음과 같습니다.
규칙 1
원소의 산화 상태는 항상 0입니다. 원소 형태의 요소는 산화 상태가 0입니다.
예 :나트륨 (NA)의 산화 상태는 0이고 수소의 산화 상태 (H 2 )는 0
입니다 규칙 2
분자 또는 이온의 총 전하는 화합물의 각 원자의 전하의 합이
입니다.
예 :KCl 총 요금은 0
입니다
K의 전하 (산화 상태)는 +1
입니다
Cl의 전하 (산화 상태)는 -1
이다 규칙 3
그룹 1 요소의 산화 상태는 항상 +1입니다.
규칙 4
그룹 2 요소의 산화 상태는 항상 +2입니다.
규칙 5
음전하는 그것에 결합 된 다른 원자와 비교하여 가장 전기 음성 원자에 주어진다.
예 :불소는 가장 전기 음성 요소입니다. 따라서 다른 원소와 결합 할 때마다 불소가 -1 산화 상태가 제공됩니다.
규칙 6
수소의 산화 상태 (H)는 +1입니다.
그러나 그룹 1 금속에있을 때 수소의 산화 상태는 -1입니다.
규칙 7
산소의 산화 상태 (O)는 -2.
이다
그러나 퍼 옥사이드에서 O의 산화 상태는 -1입니다.
|
화합물
|
요소 X
|
X의 산화 상태
|
|
nh 3
|
x =n
|
-3
|
|
kmno 4
|
x =mn
|
+7
|
|
cr 2 o 7
|
x =cr
|
+6
|
원자가와 산화 상태의 차이
정의
밸런스 : 원자가는 특정 요소의 가장 바깥 쪽 쉘에 존재하는 전자의 수로 정의 될 수 있습니다.
산화 : 산화 상태는 특정 원자가 다른 원자를 잃거나, 얻거나 공유 할 수있는 전자의 수로 정의 될 수 있습니다.
전하
원자가 : 원자가는 화합물에서 원자의 전하를 나타내지 않습니다.
산화 : 산화 상태는 화합물에서 원자의 전하를 나타냅니다.
본딩
원자가 : 원자가는 원자가 가질 수있는 최대 채권 수를 결정합니다.
산화 : 산화 상태는 특정 원자가 가질 수있는 결합의 수를 나타내지 않습니다.
순수 요소
밸런스 : 순수한 요소의 원자가는 원자의 가장 바깥 쪽 쉘에있는 전자의 수 (기체상의 원자)에 따라 다릅니다.
산화 : 순수한 원소의 산화 상태는 항상 0입니다.
결론
원자가와 산화 상태는 동일한 값 또는 다른 값을 가질 수 있습니다. 원자가는 특정 요소의 가장 바깥 쪽 쉘에 존재하는 전자의 수이고 산화 상태는 특정 화합물의 원소가 손실되거나 얻은 전자의 수입니다. 이것이 원자가와 산화 상태의 주요 차이점입니다.